Первое начало термодинамики простого тела
Простым телом называют тело, состояние которого вполне определяется двумя независимыми переменными (Р, u; u, t; Р, t).
Для таких тел термодинамическая работа определяется как обратимая работа изменения объема:
dL=P×dV; dl=dL/G=P×du.
При изучении процессов перемещения газов или жидкостей из области одного давления в область другого в расчеты вводится потенциальная работа:
dw = -u×dP = P×du-d(Pu).
I начало термодинамики по балансу рабочего тела для замкнутого пространства и единицы количества вещества запишется:
dq=dq*+dq**=dU+dl=dh+dw=dU+P×du=dh-u×dP, (3.37)
где h=U+P×u — энтальпия (см. параграф 3.1.2).
По внешнему балансу теплоты и работы запишется:
Q*1,2=dU+dl*=dh+dw*. (3.38)
3.1.6. Понятие теплоёмкости
Теплоемкостью называется отношение количества тепла по балансу рабочего тела к изменению температуры этого тела в рассматриваемом процессе (z), включающем внешний и внутренний теплообмен.
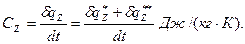 (3.39)
(3.39)
Величина qz в уравнении зависит не только от интервала температур t2 — t1, но и от вида процесса подвода теплоты. Индекс z обозначает тот параметр, который сохраняется постоянным в данном процессе. В термодинамике обычно пользуются понятием теплоемкости при Р=idem и u=idem.
u=idem  , (3.40)
, (3.40)
P=idem  . (3.41)
. (3.41)
Различают теплоемкость массовую, мольную и объемную:
массовая теплоемкость: Cz Дж/(кг×К);
мольная теплоемкость: 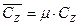 Дж/(кмоль×К);
Дж/(кмоль×К);
объемная теплоемкость: 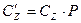 Дж/(м3×К);
Дж/(м3×К);
средняя теплоемкость: Сzm 
Если Сz является линейной функцией от температуры, то Cz=a0+ +a1×tma, т. е. Сzm=Cz(tma).
Например, в (h, t) координатах при P=idem (рис. 3.9):
Сp=tgj= 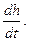
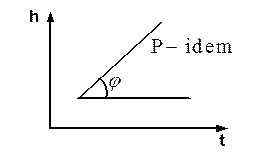 Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.
Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.
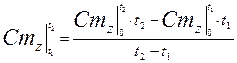 (3.42)
(3.42)
Рис. 3.9. Определение массовой тепло-
емкости при постоянном давлении
Если теплоемкость не является линейной функцией от температуры, то осреднение производится известными методами Гаусса, Чебышева, Ньютона.
В случае смеси идеальных газов в расчетные соотношения термодинамики входит теплоемкость смеси.

Рис. 3.10. Схемы смешения при постоянном объеме и давлении
Различают две схемы смешения: при V=idem и P=idem (рис. 3.10). При V=idem смешение осуществляется при неизменном уровне внутренней энергии, а при P=idem — при неизменном уровне энтальпии.
На основании I начала термодинамики определяется средняя температура смеси:
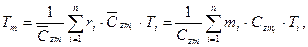
где  — средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;
— средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;
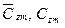 — средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):
— средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):
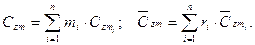
Дата добавления: 2015-10-13; просмотров: 1012;
