Законы идеальных газов
Идеальным газом является газ, подчиняющийся уравнению Клапейрона при любых плотностях и давлениях.
1. Закон Бойля — Мариотта(1622 г.). Если температура газа постоянна, то давление газа и его удельный объем связаны зависимостью:
P1u1=P2u2=idem, или u2/u1=P1/P2. (3.25)
2. Закон Гей — Люссака(1802 г.). При постоянном давлении объем газа при нагревании изменяется прямо пропорционально повышению температуры:
u=u0(1+at), (3.26)
где u — удельный объем газа при температуре t°C,
u0 — удельный объем газа при температуре t=0°С,
a — температурный коэффициент объемного расширения идеальных газов при t=0°C одинаковый для различных газов и сохраняющий одно и то же значение: a=1/273,16=0,00366 1/°С.
3. Закон (уравнение) Клапейрона (1834 г.). Сопоставление законов Бойля — Мариотта и Гей — Люссака приводит к уравнению состояния идеальных газов:
u=u0(1+at)=const/P=a×const/P(1/a+t);
1/a+t=T; a×const=R; T=273,16+t°C;
Pu=RT; PV=GRT=MRT, (3.27)
где R — газовая постоянная идеального газа. Представляет собой удельную работу газа в изобарном процессе (P — idem) при изменении температуры газа на 1°С.
4. Закон Авогадро (1811 г.). Объем киломоля идеального газа ( 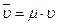 ) не зависит от его природы и вполне определяется параметрами физического состояния газа (P, t):
) не зависит от его природы и вполне определяется параметрами физического состояния газа (P, t):
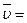 ƒ(P, t).
ƒ(P, t).
Объем 1 кмоля идеального газа в нормальных физических условиях (температура 0°С, давление 101,325 кПа)
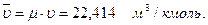
Уравнение Клапейрона для одного кмоля идеального газа имеет вид
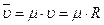 ,
,
тогда mR не зависит от природы газа и в силу этого называется универсальной газовой постоянной:
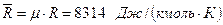 . (3.28)
. (3.28)
Удельные газовые постоянные газов R определяются по значению их молярной массы:
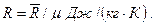 (3.29)
(3.29)
Таким образом, уравнение состояния идеального газа (уравнение Клапейрона) может быть записано в следующих видах:
для 1 кг газа Pu=RT,
для G кг газа PV=GRT,
для 1 кмоля газа (уравнение Клапейрона — Менделеева)
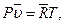
для 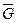 кмолей газа
кмолей газа 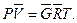 (3.30)
(3.30)
Дата добавления: 2015-10-13; просмотров: 941;
