Закон Майера
Для идеальных газов справедливо утверждение, что внутренняя энергия U и энтальпия h являются функциями только одной температуры (закон Джоуля):
U=u(t); h=u+P×u=u(t)+RT=h(t). (3.43)
В этих условиях упрощаются выражения теплоемкости:
u=idem CV=(¶u/¶t)V=dU(t)/dt=CV(t);
P=idem Cp=(¶h/¶t)p=dh(t)/dt=Cp(t);
dU=CV×dt; dh=Cp×dt.
Тогда первое начало термодинамики для идеального газа по балансу рабочего тела:
dq=dq*+dq**=CV×dt+P×du=Cp×dt-u×dP. (3.44)
Из этого соотношения следует закон Майера, устанавливающий равенство между разностью теплоемкостей Ср и Сu и удельной газовой постоянной R.
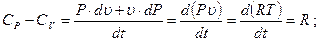
Сp-CV=R. (3.45)
Для молярных теплоемкостей:
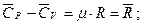
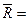 8314 Дж/(кмоль×К).
8314 Дж/(кмоль×К).
Дата добавления: 2015-10-13; просмотров: 1762;
