Методы кuслотно-основного титрования.
1.1 Алкалиметрический метод, вариант нейтрализации
для определения кислоты салициловой. Титрование ведут в спиртовой среде для превращения гидролиза образующихся натриевых солей. В качестве индикатора используют фенолфталеин.
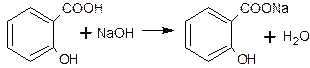
1.2 Ацидиметрический метод, вариант вытеснения
для определения в водной среде натрия салицилата – это соль сильного основания и слабой кислоты (см. натрия бензоат).
Титрование ведут в присутствии эфира (среда), извлекающего из реакционной среды образующуюся кислоту, которая может изменять окраску до т.э. Эфир подавляет её диссоциацию.
Создается двухфазная система водный слой-эфир. Реакция идет в водном слое, салициловая кислота по мере образования извлекается в верхний эфирный слой. Индикатор смешанный (метилоранж и метиленовый синий в соотношении 2:1). В т.э. переход окрашивания из зеленого в фиолетовое.
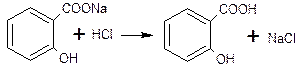
1.3 МФ III Ацидиметрический метод титрования натрия салицилата в среде протогенного растворителя (неводное титрование).Растворитель - ледяная CH3COOH, которая повышает основные свойства карбоксилат-ионов. Индикатор кристаллический фиолетовый. Титрант - HClO4 хлорная кислота
|
 | |||
| |||
Механизм метода:
R - COONa + СН3СООН → RCOOH + СН3СОО- + Na+
ацетат-ион
НCIO4 + СН3СООН → СН3СООН2+ + CIO4-
ацетоний-ион перхлорат-ион
СН3СОО- + СН3СООН2+ → 2СН3СООН
Na++ CIO4 - → NaCIO4

Суммарно RCOONa + НCIO4 → RCOOH + NaCIO4
fэкв = 1/n, где n - количество СОО- в молекуле, которые титруются.
2. Методы галогенирования. Основаны на реакции электрофильного замещения атомов водорода ароматического кольца на атомы галогена.
2.1.Броматометрический,вариант обратного титрования
(салициловая кислота, натрия салицилат).
КBгО3+ 5 КBr + 6 НСl → 3 Вr2 + 6KCl + ЗН2О
|  | |||
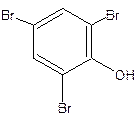
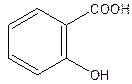
 |
Br2 + 2КI → I2 + 2КВг
I2 + 2 Na2S2О3 → 2NaI + Na2S406
f экв. (кислоты силициповой) = 1/6
Бромирование салициловой кислоты и натрия салицилата идёт с декарбоксилированием. Это происходит в результате согласованной ориентации -ОН и -СООН групп.
KBrO3 + 5KBr + 6HCL → Br2 + 6KCL + 3H2O
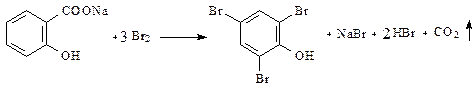
Br2 + 2KJ → J2 + 2KBr
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
2.2. Йодометрический или йодхлорметрический (кислота салициловая).
в лекции нет
| |||
 | |||
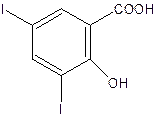
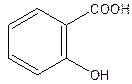
|
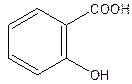
| |||
 |
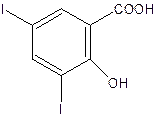
 |
IСl + 2КI → I2 + 2КСl
Избыток йода титруют раствором натрия тиосульфата.
I2 + 2 Na2S2О3 → 2 NaI + Na2S406
f экв (кислоты салициловой) = 1/4
Йодирование идёт без декарбоксилирования.
Дата добавления: 2015-09-07; просмотров: 4074;
