Химические свойства. 1. Кислотные свойства. Обусловлены наличием в молекуле двух енольных гидроксилов (или диенольной группы):
1. Кислотные свойства. Обусловлены наличием в молекуле двух енольных гидроксилов (или диенольной группы):
Является γ –лактоном, содержащим два спиртовых гидроксила в 5 и 6 положениях и два енольных гидроксила во 2 и 3 положениях. Енольные гидроксилы обладают кислотными свойствами.
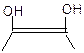
Подвижность водородных атомов обуславливает кислотные свойства – сопряжение с карбоксильной группы с двойной связью усиливает кислотность. Дают кислую реакцию на лакмус (красный).
При действии разбавленными растворами щелочей, карбонатов, гидрокарбонатов ведет себя как одноосновная кислота, образуя растворимые монозамещенные соли по гидроксилу в положении 3, его кислотные свойства более выражены:
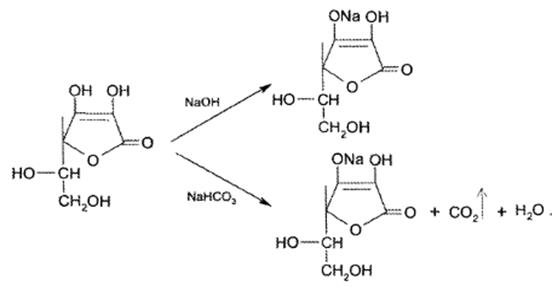
В сильно щелочной среде (рН > 12-13)со щелочью будет взаимодействовать и другая гидроксильная группа.
Разрыва лактонного кольца под действием щелочи не происходит, т.к. лактон стабилизирован за счет наличия двойной связи
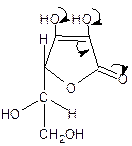
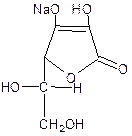
| |||
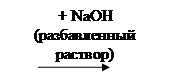 | |||
|
|
Енольный гидроксил во втором положении обладает меньшей реакционной способностью, т.к. участвует в образовании внутримолекулярной водородной связи в результате взаимодействия протона с неподеленной электронной парой атома кислорода (мезомерный эффект).
В сильно щелочной среде (рН > 12-13) со щелочью будет взаимодействовать и другая гидроксильная группа.
Разрыва лактонного кольца под действием щелочи не происходит, т.к. лактон стабилизирован за счет наличия двойной связи. π-Электроны этой связи вступают в сопряжение с лактонной карбонильной группой в положении 1.
Образует тетраметиловой эфир за счет 4 гидроксильных атамов.
При католическом гидрировании поглощает 1 моль водорода – 1 двойная связь.
Восстановительные свойства. Кислота аскорбиновая обладает сильной восстанавливающей способностью и легко окисляется.
1. Способность к окислению обусловлена подвижностью атомов водорода ендиольной группировки. Особенно легко окисление протекает в растворах. При окислении кислоты аскорбиновой образуется кислота дегидроаскорбиновая. Процесс является обратимым.
1 стадия обратимое окисление образование дегидроаскорбиновой кислоты
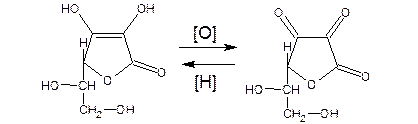
енольная форма кетонная форма
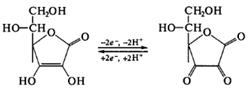
Так как реакция окисления-восстановления является обратимой,· кислота аскорбиновая может служить переносчиком водорода в ферментативных системах и участвовать в окислительно-восстановительных процессах в организме.
2 стадия.
При длительном воздействии окислителей,
под воздействием света,
воздуха,
температуры t°,
сильнощелочной или кислой среды,
следов металлов
может произойти необратимое окисление кислоты аскорбиновой.
Продукт окисления желтого цвета- фурфурол не обладает фармакологическим действием. Промежуточные продукты окисления: дегидроаскорбиновая кислота и 2.3-дикетогулоновая кислота.
при действии сильных щелочей (необратимый процесс):NaOH 30%
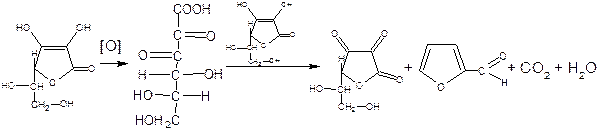
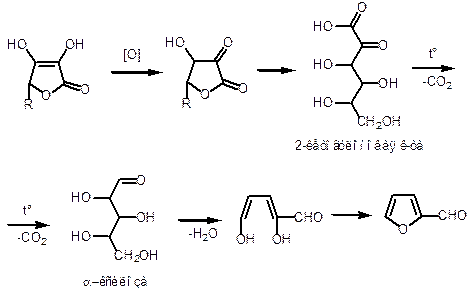 фурфурол
фурфурол
Процесс приготовления, стерилизации, хранения аскорбиновой кислоты должен производиться с учетом окисления до фурфурола. Для предотвращения окисления к аскорбиновой кислоте добавляют
стабилизатор и антиоксидант – натрия сульфит или натрия метабисульфит.
Дата добавления: 2015-09-07; просмотров: 2919;
