Задачи и упражнения. 1. Укажите возможные степени окисления следующих элементов: а) Cu; б) Ag в) Zn
1. Укажите возможные степени окисления следующих элементов: а) Cu; б) Ag в) Zn. Приведите примеры соответствующих соединений.
2. Какие свойства (основные, кислотные, окислительные, восстановительные) имеют соединения: а) Cu+2; б) Ag+1, в) Zn+2. Напишите уравнения соответствующих реакций.
3. Напишите уравнения реакций свойств соединений меди и серебра:
| Cu + H2SO4 (конц.) ® | Ag + HCl ® |
| Cu + HNO3 (конц.) ® | Cu + HNO3 (разб.) ® |
| Cu + H2SO4 (разб.) + H2O2 ® | AgNO3 + NaOH ® |
| CuSO4 + KI ® | CuSO4 + *NaOH ® |
Cu(OH)2 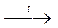
| Cu(NO3)2 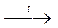
|
| CuSO4 + NH3´H2O ® | AgCl + NH3´H2O ® |
4. Напишите уравнения реакций свойств соединений цинка:
| Zn + NaOH + H2O ® | Zn + H2SO4 (конц.) ® |
ZnO + NaOH 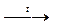
| Zn(NO3)2 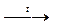
|
| ZnCl2 + NaOH (избыток) ® | Na2[Zn(OH)4] + HCl (недостат.) ® |
| Zn(OH)2 + NH3´H2O ® | Zn(OH)2 + NaOH ® |
5. Напишите уравнения реакций следующих превращений:
a) Cu ® Cu(NO3)2 ® CuO ® CuCl2 ® Cu(OH)2 ® CuO ® Cu
б) Zn ® Na2[Zn(OH)4] ® ZnSO4 ® ZnCl2 ® Zn(OH)2 ® ZnCl2 ® Zn
в) Cu ® CuSO4 ® [Cu(NH3)4]SO4 ® CuSO4 ® CuI
г) Ag ® AgNO3 ®AgCl ® [Ag(NH3)2]Cl ® AgCl ® Ag2S
д) Cu ® CuCl2 ® ZnCl2 ® Na2[Zn(OH)4] ® ZnSO4 ® Zn(NO3)2 ®
® Zn
6. Насыщенный раствор медного купороса содержит 27,1% СuSO4×5H2O. Чему равна массовая доля безводной соли CuSO4?
7. Какой объем водорода (н.у.) выделяется при взаимодействии 130 г металлического цинка с соляной кислотой?
8. В каких растворах кислых или щелочных восстановительные свойства цинка выражены сильнее, если
| Zn2+ + 2e = Zn0 | Еo = - 0,76в |
| ZnO22- + 2H2O + 2e = Zn0 + 4OH- | Еo = - 1,26в |
9. При обжиге соли металла(II) в избытке воздуха получили смесь двух оксидов, один из которых газообразный. Такое же количество этого газообразного оксида выделяется при нагревании 25,6 г меди с концентрированной серной кислотой. Второй оксид, содержащий 80,24% металла(II), обработали 146 мл раствора соляной кислоты с w=0,10 и r=1,05 г/мл. Определите массу нерастворившегося остатка.
10. В раствор сульфата меди(II) поместили пластинку железа массой 61,26 г. После того, как пластинку вынули из раствора, промыли и просушили, ее масса оказалась равной 62,8 г. Найти массу меди, выделившейся на пластинке.
11. 12,8 г сплава меди с алюминием обработали избытком соляной кислоты. Остаток промыли и растворили в концентрированной азотной кислоте. Этот раствор выпарили, а сухой остаток прокалили. Масса вещества после прокаливания равна 4 г. Определите массовую долю меди в сплаве.
12. Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л газа (н.у.). Нерастворившийся осадок отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Определите массовую долю меди в сплаве.
Дата добавления: 2015-09-07; просмотров: 1626;
