РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ.
У сучасній літературі прийнято розглядати 4 рівні організації структури молекули білка.
Первинним рівнем (або структурою) – організації білкової молекули називають послідовність амінокислотних залишків, з'єднаних між собою пептидним зв'язком.
Вторинною структурою – називають просторове розташування атомів головного ланцюга молекули білка. Утворюється і утримується в просторі за рахунок утворення водневих зв'язків між боковими угрупуваннями АК основного ланцюга.
Третинна структура – це властивий даному білку спосіб укладання поліпептидного ланцюга у просторі. Це основа функціональності білка. Вона забезпечує стабільність обширних ділянок білків, що складаються з безлічі амінокислотних залишків та бокових груп. Такі впорядковані в просторі ділянки білка формують активні центри ферментів або зони зв'язування. Пошкодження третинної структури приводить до втрати функціональної активності білка.
Стабільність третинної структури залежить в основному від нековален-тних взаємодій всередині білкової глобули, а переважно водневих зв'язків і ван-дер-ваальсових сил. Але деякі білки додатково стабілізуються за рахунок таких ковалентних взаємодій як дисульфідні містки між залишками цистеїну.
Більшість білкових молекул мають ділянки як α-спіралі так і β-складчастості. Але частіше за формою третинної структури білки розділяють на глобулярні – які побудовані на основі α -спіралі і мають форму кулі або еліпса (більшість ферментів). І фібрилярні – що складаються на основі β-складчастості і які мають сплюснуту або ниткоподібну форми (пепсин, білки сполучної тканини і хряща).
Четвертинною структурою – називається розміщення в просторі взаємодіючих між собою субодиниць, утворених окремими поліпептидними ланцюгами. Тобто у формуванні четвертинної структури беруть участь не пептидні ланцюги, а глобули, які утворені з кожного з цих ланцюгів окремо. Четвертинна структура – це вищий рівень організації білкової молекули і він властивий далеко не всім білкам. Зв'язки, що формують цю структуру не ковалентні: водневі, електростатичної взаємодії.
Фізико-хімічні властивості білків. Розчини білка відносять до розчинів високомолекулярних систем які володіють низкою властивостей гідрофільних колоїдів: повільною дифузією – не здатні проникати через напівпроникні мембрани, високою в'язкістю – утворення драглів, опаслеценцією – розсіюють світло, дають конус Тіндаля.
1.Амфотерністьпов'язана з наявністю в молекулі білка катіонообра-зуючих груп – аміногруп і аніонообразуючих – карбоксильних груп. Знак заряду молекули залежить від кількості вільних груп. Якщо мають перевагу карбоксильні групи то заряд молекули негативний (виявляються властивості слабої кислоти), якщо аміногрупи – то позитивний (основні властивості).
Заряд білка також залежить від рН середовища. У кислому середовищі молекула набуває позитивного заряду, в лужній – негативного.
Значення рН, при якому число різнойменних зарядів в білковій молекулі однаково, тобто сумарний заряд рівний нулю, називається ізоелектричною точкоюданогобілка. Стійкість білкової молекули до дії фізичних і хімічних факторів в ізоелектричній точці найменша.
Більшість природних білків містять значну кількість дикарбонових амінокислот і тому відносяться до кислих білків. Їх ізоелектрична точка лежить в слабокислому середовищі.
2. Розчини білків володіють буферними властивостямиза рахунок їх амфотерності.
3. Розчинність. Оскільки молекула білка містить полярні аміно- і карбоксильні групи, то в розчині поверхневі залишки АК гідратуються – відбувається утворення коацервата.
4.Коацервація– злиття водних оболонок декількох часток, без об'єднання самих часток.
5.Коагуляція– склеювання білкових часток і випадіння їх в осад. Це відбувається при видаленні їх гідратної оболонки. Для цього досить змінити структуру частинки білка так, щоб її гідрофільні групи, які зв'язують воду розчинника, опинилися всередині частинки. Реакції осадження білка в розчині діляться на дві групи: зворотні (висолювання) і незворотні (денатурація).
6. Висолюванням називається процес осадження білків нейтральними солями. За великих концентрацій іонів у розчині вони відтягають молекули води від полярних груп білка на себе. При цьому гідратна оболонка білкової молекули частково знімається, тобто порушується один з факторів стійкості білка в розчині, а отже, осадження білка з розчину. Характерною рисою білків, отриманих при висолюванні, є збереження ними своїх природних властивостей і функцій після видалення солі.
Денатурацієюназивається суттєва зміна вторинної і третинної структури білка, тобто порушення системи нековалентних взаємодій, що не зачіпає його ковалентної (первинної) структури. Денатурація буває незворотною й зворотною. Денатурований білок позбавлений всякої біологічної активності в клітині і в, основному, використовується як джерело амінокислот. Денатуруючими агентами можуть бути хімічні фактори: кислоти, луги, що легко гідратують, солі, органічні розчинники, різні окиснювачі. До фізичних факторів можуть бути віднесені: дія високого тиску, багатократне заморожування і відтаювання, ультразвукові хвилі, УФ-промені, іонізуюча радіація. Та найбільш поширеним фізичним фактором денатурації білка є підвищення температури. Така денатурація називається незворотною.
Денатурація білка, яка відбувається при розтиранні сухих препаратів, енергійному струшуванні розчинів, збиванні, ліофілізації білків (висушування у вакуумі шляхом сублімації вологи з замороженого стану) – називається зворотною.
Класифікація білків:
За розчинністю: водорозчинні, сольоворозчинні, спирторозчинні, нерозчинні і ін.
По конформаційній структурі: фібрілярні, глобулярні.
По хімічній будові: прості білки – протеїни – складаються тільки з амінокислот, складні білки – протеїди – крім АК мають в складі небілкову частину (вуглеводи, ліпіди, метали, нуклеїнові кислоти)
До протеїнів відносять:
1. Альбуміни – розчинні у воді, не розчинні у концентрованих. сольових розчинах рН = 4,6…4,7. Існують альбуміни молока, яєць, сироватки крові.
2. Глобуліни – не розчинні у воді, розчинні у сольових розчинах. До цієї групи відносять імуноглобуліни.
3. Гістони – розчинні у воді, у слабоконцентрованих кислотах. Володіють вираженими основними властивостями. Це ядерні білки, вони пов'язані з ДНК і РНК.
4. Склеропротєїни – білки опорних тканин (хрящів, кісток), шерсті, волосся. Не розчинні у воді, слабких кислотах і лугах.
а) колагени – фібрілярні білки сполучної тканини. При тривалому кип’ячені вони розчиняються у воді і при застиганні утворюється желатин.
б) еластини – білки зв'язок і сухожиль. По властивостях схожі на колаген, але піддаються гідролізу під дією ферментів травного соку;
в) кератин – входить до складу волосся, пір'я, копит;
г) фиброін – білок шовку, в своєму складі містить багато серину;
д) проламіни і глютеніни – білки рослинного походження.
Протеїди
Ці білки залежно від її хімічної природи простетичної групи класифікуються на:
1. Нуклеопротєїди – простетична група – нуклеїнові кислоти. Серед численних класів нуклепротеідів найбільш вивченими є рибосоми, що складаються з декількох молекул РНК і рибосомних білків, і хроматин, який складається з ДНК і структурообразуючих білків – гістонів (містяться в клітинному ядрі і мітохондріях).
2. Гемопротєїди – небілковий компонент цих протеїдів – гем, побудований з чотирьох пирольних кілець. З ними пов'язаний іон двовалентного заліза (через атом азоту). До таких білків відносяться: гемоглобін, міоглобін, цитохроми. Цей клас білків ще називають хромопротеїди, оскільки гем є забарвленим з'єднанням. Гемоглобін здійснює важливу функцію – транспортує Оксиген та вуглекислоту. Міоглобін забезпечує запасання Оксигену в м'язах. Цитохроми (гемінові ферменти) здійснюють каталіз окиснювально-відновлювальних реакцій і електронний транспорт у дихальному ланцюзі.
3. Металопротєїди – до складу простетичної групи входять метали. Хлорофіл містить гем, але в ньому замість заліза знаходиться магній. Цитохроми містять мідь.
4. Ліпопротєїди – крім білка містять ліпіди. Вони входять до складу клітинних мембран.
5. Фосфопротєїди – крім білка містять залишок фосфорної кислоти.
6. Глюкопротєїди – крім білка містять вуглеводи.
Біологічна цінність білків.
Білки – найважливіші компоненти харчування. Здатність білка виконувати функцію харчування характеризує його біологічну цінність. Ефективність споживання білкових речовин людиною визначається двома основними факторами: збалансованістю вмісту незамінних амінокислот у білку і його засвоюваністю. Якщо не задовольняється потреба в одній з незамінних амінокислот, то обмежується використання інших, і, отже, знижується цінність білка в цілому. Незамінна амінокислота, що знаходиться в білку в мінімальній кількості, називається лімітуючою амінокислотою, тому що вона найбільшою мірою зменшує біологічну цінність даного білка.
Збагачення харчових білкових продуктів відсутніми амінокислотами застосовується в харчуванні людини у виняткових випадках. Однак додавання синтетичних амінокислот до кормів тварин є звичайною справою. Подібним чином в усьому світі готують кормові суміші для домашніх птахів, свиней, корів, що дозволяє більш ощадливо витрачати корми. Відомо, що добавки цих амінокислот поліпшують утилізацію білка тваринами приблизно на 20 %.
Біологічна цінність білка виражається у відносних величинах. Вона являє собою відношення досліджуваного параметра даного білка до подібного ж параметра «ідеального» білка. У якості останнього використовують казеїн молока, білок яєць, суміш м'язових білків, що легко переварюються і містять незамінні амінокислоти в співвідношеннях, близьких до еталонних. Біологічна цінність даного білка в порівнянні з еталонними показує, наскільки він здатний задовольняти потреби організму в амінокислотах. Для оцінки якого-небудь білка або харчового продукту необхідні дані про вміст у ньому окремих амінокислот, тобто його амінокислотний склад.
Частина рослинних білків (бобові) за своїм амінокислотним складом і біологічною цінністю близька до тваринних. Однак білки насіння більшості сортів зернових (рис, овес) дефіцитні за двома, а частіше (пшениця, кукурудза й ін.) за трьома і чотирма незамінними амінокислотами. Основною лімітуючою амінокислотою білків зернових культур є лізин. Лімітуючі амінокислоти білків зернових різні в насінні різних культур: у пшениці, рисі і житі – треонін, у кукурудзі – триптофан і т.д. Білки бобових культур відрізняються кращою збалансованістю незамінних амінокислот, що містяться в них, у порівнянні з білками злакових.
У тваринних білків дефіцит незамінних амінокислот виражений слабко. Деяким з них (білки молока, м'яса, субпродуктів) властивий недолік сірковміс-них амінокислот. У цілому для тваринних білків більш характерний надлиш-ковий в порівнянні з потребами організму вміст ряду незамінних амінокислот.
У харчуванні більшої частини населення земної кулі наявний дефіцит трьох незамінних амінокислот: лізину, триптофану і метіоніну. Різний амінокислотний склад рослинних і тваринних білків дозволяє підвищити їхню біологічну цінність при споживанні необхідної кількості різноманітної білкової їжі. Тільки таке харчування можна назвати повноцінним.
Амінокислоти, номенклатура та будова.
Білки – полімери, що не розгалужуються, мінімальна структурна одиниця яких – амінокислота (АК). Амінокислоти з'єднані між собою пептидним зв'язком. У природі зустрічається близько 300 амінокислот, їх можна умовно розділити на дві групи:
1) вільні амінокислоти (непротеїногенні), що не беруть участь в утворенні білків. Так, безліч «небілкових» АК міститься в пептидних антибіотиках або є проміжними продуктами обміну білків.
2) протеїногенні, які ковалентно зв'язані одна з одною у складі пептидів і білків.
Непротеїногенні амінокислоти більш різноманітні в порівнянні з протеїногенними.
До складу білків входить 20 АК у α-формі, розташованих в різній, але строго визначеній для кожного білка послідовності. Загальна структурна формула a-амінокислот може бути представлена в наступному виді:
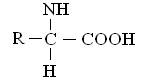
a- амінокислоти відрізняються одна від однієї структурою і складом групи R (бічний ланцюг).
Амінокислоти класифікуються відповідно:
за хімічною будовою
- Аліфатичні – гліцин (Глі), аланин (Ала), валін (Вал), лейцин (Лей), ізолейцин (Іле);
- Оксикислоти – серін (Сер), треонін (Тре);
- Дикарбонові – аспарагінова кислота (Асп), глутамінова кислота (Глу);
- Двоосновні – лізин (Ліз), гістидин (Гіс), аргінін (Арг);
- Ароматичні – феніналанін (Фен), тирозин (Тир), триптофан (Три);
- Сіркоутримуючі – цистеін (Цис), цистин (Цит), метіонін (Мет).
За біохімічним призначенням:
- Глюкогенні – через ряд хімічних перетворень надходять на шлях глі-колізу (окиснення глюкози) – Глі, Ала, Тре, Вал, Асп, Глу, Арг, Гіс, Мет.
- Кетогенні – беруть участь в утворенні проміжних продуктів ліпідного обміну кетонових тіл – Лей, Іле, Тир, Фен.
За харчовою цінністю:
- Незамінні – не синтезуються в організмі – Гис, Іле, Лей, Ліз, Мет, Фен, Тре, Три, Вал, а у дітей – Арг, Гис.
- Замінні – інші.
За рахунок наявності в молекулі АК одночасно амінної і карбоксильної груп цим сполукам властиві кислотно-основні властивості. У нейтральному середовищі АК існують у вигляді біполярних іонів.
Фізико-хімічні властивості амінокислот. За хімічними властивостями амінокислоти, що мають у своєму складі амінні і карбоксильні групи, є амфотерними електролітами.
Сучасна класифікація амінокислот основана на полярності радикалів.
Крім a-аміно- і a-карбоксильної груп, у загальному заряді молекули в складі кислих і основних амінокислот є ще і третя – іоногенна група в бічному ланцюзі. Такі амінокислоти несуть додатковий негативний або позитивний заряд.
Біполярність молекул амінокислот обумовлює такі їхні властивості, як гарна розчинність у воді, високі значення діелектричних постійних і температури плавлення.
Функціональні групи амінокислот різноманітні, що дозволяє виявляти більшість їх за допомогою кольорових реакцій. Багатьох з них, дуже чуттєвих і специфічних, виявляють навіть в малих кількостях у складі складних сумішей, біологічній сировині рослинного і тваринного походження, білках. Реакція з нінгідрином лежить в основі кількісного визначення амінокислот і білків.
При взаємодії нінгідрину з a-аміногрупою утворюється продукт синьо-фіолетового кольору з максимумом поглинання при 580 нм; інтенсивність фарбування при цьому пропорційна кількості амінокислоти. Амінокислота пролін дає з нінгідрином жовте фарбування (максимум поглинання при 440 нм). Цю реакцію використовують у різних видах хроматографії для ідентифікації і кількісного визначення амінокислот.
Таблиця 1– Класифікація протеїногенних амінокислот
| Назва | Структура | Скорочена назва | |||
| I. Неполярні або гідрофобні амінокислоти | |||||
| l. L-Аланін (α –амінопропіонова кислота) | 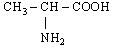
| Ала (Ala) | |||
| 2. L-Валін (α – аміноізовалеріанова кислота) | 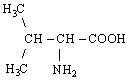
| Вал (Val) | |||
| 3. L-Лейцин (α – аміноізокапронова кислота) | 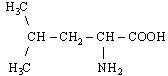
| Лей (Leu) | |||
| 4. L-Ізолейцин (α-аміно-β-метилвалеріанова кислота) | 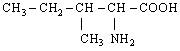
| Иле (Ile) | |||
| 5. L-Триптофан (α-аміно-β-індолілпропіонова кислота) | 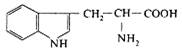
| Три (Try) | |||
| 6. L-Пролін (пірролідин-α-карбонова кислота) | 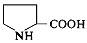
| Про (Pro) | |||
| 7. L-Фенілаланін (α-аміно-β-фенілпропіонова кислота) | 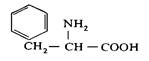
| Фен (Phe) | |||
| 8. L-Метіонін (α-амино-γ-метилтіомасляна кислота) | 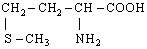
| Мет (Met) | |||
| II. Полярні (гідрофільні) незаряджені амінокислоти | |||||
| 9. Гліцин (амінооцтова кислота) | 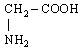
| Гли (Gly) | |||
| 10. L-Серин (α-аміно-β-оксипропіонова кислота) | 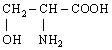
| Сер (Ser) | |||
| 11. L-Треонін (α-аміно-β-окси-масляна кислота) | 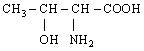
| Тре (Thr) | |||
| 12. L-Цистеїн (α-аміно-β-тіопропіонова кислота) | 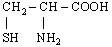
| Цис (Cys) | |||
| 13. Цистин | 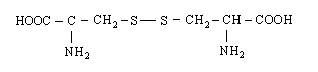
| Цит (Cyt) | |||
| 14. L-Тирозин (α-аміно-β-параоксифенілпропіонова кислота) | 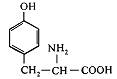
| Тир (Туr) | |||
| 15. L-Аспарагін (амід аспарагінової кислоти) | 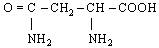
| Асн (Asn) | |||
| 16. L-Глутамин (амід глутамінової кислоти) | 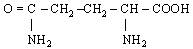
| Глн (Gln) | |||
| III. Негативно заряджені (кислі) амінокислоти | |||||
| 17. L-Аспарагінова кислота (α-амінобурштинова кислота) | 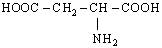
| Асп (Asp) | |||
| 18. L-Глутамінова кислота (α-аміноглутарова кислота) | 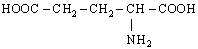
| Глу (Glu) | |||
| IV. Позитивно заряджені (основні) амінокислоти | |||||
| 19. L-Лізин (α, ε-диамінокапронова кислота) | 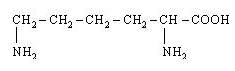
| Лиз (Lys) | |||
| 20. L-Аргінін (α-аміно-β-гуанідинвалеріанова кислота) | 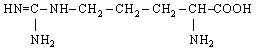
| Арг (Arg) | |||
| 21. L-Гістидин (α-аміно-β-імідазолілпропіонова кислота) | 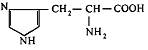
| Гис (His) | |||
Аміногрупи амінокислот (пептидів, білків) можуть вступати в реакцію з карбонільними групами альдегідів і цукрами, що відновлюються. Це реакції меланоїдиноутворення.
Одержувані з амінокислот альдегіди мають приємний запах. Сполучення запахів різних альдегідів визначає аромат багатьох харчових продуктів. Фурфурол (оксиметилфурфурол) легко вступає в подальші реакції, утворюючи меланоїдини. Поява останніх обумовлює потемніння ряду продуктів при їхньому виготовленні і збереженні. Особливо інтенсивно протікають реакції меланоїдиноутворення при підвищенні температури: під час сушіння овочів, плодів, випічці хліба, жаренні горіхів, кави, консервуванні молока, виготовленні кондитерських виробів, солоду, цукрових розчинів, при тепловій обробці вина і т.п.
Утворення пептидного зв'язку. Якщо карбоксильна група однієї АК ацилює аміногрупу іншої АК, то утворюється амідний зв'язок, який називають пептидним. Тому пептиди – це сполуки, які утворені з залишків a-АК, з'єднаних між собою пептидним зв'язком.
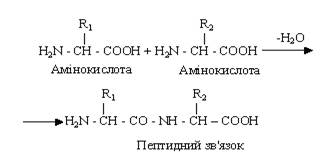
Даний зв'язок достатньо стабільний і розрив його відбувається лише за участю каталізаторів – специфічних ферментів. За допомогою такого зв'язку АК об'єднуються в достатньо довгі ланцюжки, які носять назву поліпептидних.
Початком поліпептидного ланцюга прийнято вважати амінокислоту з вільною a-аміногрупою (N – кінцева амінокислота), кінцем – амінокислоту з вільною карбоксильною групою (С – кінцева амінокислота). Найменування пептидів складається з назви першої амінокислоти з типовим для ацилів закінченням -іл, назва наступних амінокислот (також із закінченням -іл) і повної назви останньої амінокислоти (закінчення не змінюється). Наприклад, зображений нижче тетрапептид називається гліцил-аргініл-глутаміл-аланін, або скорочено Глі-Арг-Глу-Ала.
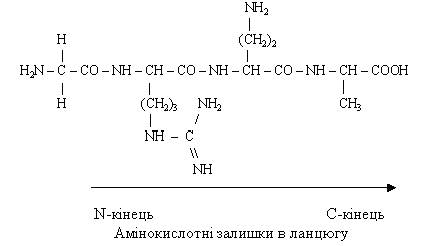
Поліпептиди, які здатні мимоволі формувати і утримувати певну просторову структуру, яка називається конформацією, відносять до білків. Стабілізація такої структури можлива лише при досягненні поліпептидами певної довжини. Тільки маючи певну просторову будову, білок може функціонувати.
Дата добавления: 2015-10-05; просмотров: 5446;
