ФерментИ. будова, властивості, класифікація.
Обмін речовин в організмі живої істоти можна визначити як сукупність всіх хімічних перетворень, яким піддаються сполуки, що надходять ззовні. Ці перетворення включають всі відомі види хімічних реакцій: міжмолекулярне перенесення функціональних груп, гідролітичне і негідролітичне розщеплювання хімічних зв'язків, внутрішньомолекулярну перебудову та новоутворення хімічних зв'язків і окиснювально-відновні реакції. Такі реакції протікають в організмі з надзвичайно великою швидкістю тільки у присутності каталізаторів. Всі біологічні каталізатори є речовини білкової природи і носять назву ферменти або ензими.
Ферменти не являються компонентами реакцій, а лише прискорюють досягнення рівноваги, збільшуючи швидкість як прямого, так і зворотного перетворення. Прискорення реакції відбувається за рахунок зниження енергії активації того енергетичного бар'єру, який відокремлює один стан системи (початкову хімічну сполуку) від іншого (продукт реакції).
Ферменти прискорюють самі різні реакції в організмі. Так, достатньо проста з погляду традиційної хімії реакція відщеплення води від вугільної кислоти з утворенням СО2 вимагає участі ферменту, оскільки без нього вона протікає дуже повільно. Ця реакція важлива для регулювання рН крові. Завдяки каталітичній дії ферментів в організмі стає можливим протікання таких реакцій, які без каталізатора протікали б в сотні і тисячі разів повільніше.
Властивості ферментів:
1. Вплив на швидкість хімічної реакції: ферменти збільшують швидкість, направленість та послідовність хімічної реакції, але самі при цьому не витрачаються.
Швидкість реакції – це зміна концентрації компонентів реакції в одиницю часу. Якщо вона йде в прямому напрямі, то пропорційна концентрації реагуючих речовин, якщо в зворотному – то пропорційна концентрації продуктів реакції. Відношення швидкостей прямої і зворотної реакцій називається константою рівноваги. Ферменти не можуть змінювати величини константи рівноваги, але стан рівноваги у присутності ферментів настає швидше.
2. Специфічність дії ферментів. У клітинах організму протікає 2-3 тис. реакцій, кожна з яких каталізується певним ферментом. Специфічність дії ферменту – це здатність прискорювати протікання однієї певної реакції, не впливаючи на швидкість інших, навіть дуже схожих.
Розрізняють види специфічності:
Абсолютну – коли фермент каталізує лише одну певну реакцію (аріназа– розщеплювання аргініну)
Відносну – фермент каталізує певний клас реакцій (наприклад, гідролітичне розщеплювання) або реакції за участю певного класу речовин.
Стереохімічну – фермент діє на субстрати, що мають тільки визначену просторову конфігурацію, тобто виявляють просторову, оптичну, стереоізомерну специфічность.
Специфічність ферментів обумовлена їх унікальною амінокислотною послідовністю, від якої залежить конформація активного центру, що взаємодіє з компонентами реакції.
Речовина, хімічне перетворення якої каталізується ферментом, носить назву субстрат.
3. Активність ферментів – здатність різною мірою прискорювати швидкість реакції.
Активність залежить в першу чергу від температури. Найбільшу активність той або інший фермент проявляє при оптимальній температурі. Для ферменту живого організму це значення знаходиться в межах (37,0…39,0)°С, залежно від виду тварини. При пониженні температури сповільнюється броунівський рух, зменшується швидкість дифузії і, отже, сповільнюється процес утворення комплексу між ферментом і компонентами реакції (субстратами). В разі підвищення температури вище 40…50°С молекула ферменту, яка являється білком, піддається процесу денатурації. При цьому швидкість хімічної реакції помітно падає (рис. 2).
|
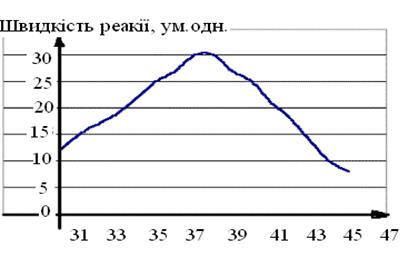
Рис. 2. Залежність швидкості реакції, яку каталізує фермент організму людини, від температури. Максимальна швидкість відповідає температурі тіла людини.
Активність ферментів залежить також від рН-середовища. Для більшості з них існує певне оптимальне значення рН, при якому їх активність максимальна. Оскільки в клітині містяться сотні ферментів і для кожного з них існують свої межі оптимуму рН-середовища, тому зміна рН – це один з важли-вих чинників регуляції ферментативної активності. Так, в результаті однієї хімічної реакції за участю певного ферменту, рН оптімум якого лежить в межах 7,0…7,2, утворюється продукт, який є кислотою. При цьому значення рН зміщується в область 5,5...6,0, активність ферменту різко знижується, швидкість утворення продукту сповільнюється, але при цьому активізується інший фермент, для якого ці значення рН оптимальні і продукт першої реакції піддається подальшому хімічному перетворенню.
Дата добавления: 2015-10-05; просмотров: 1958;
