Біологічне окисНення.
В процесі життєдіяльності організми поглинають з навколишнього середовища енергію в адекватній формі, а потім повертають її еквівалентну кількість, але вже в іншому виді.
Основним носієм енергії є електрон (е-). Одержавши визначену кількість енергії, він збуджується: переходить на більш високий енергетичний рівень. Роблячи зворотний шлях на нижню орбіту, електрон вивільняє таку ж кількість енергії.
Для всіх організмів, що живуть на Землі, основним джерелом енергії служить сонячне випромінювання. Існує дві групи організмів, що розрізняються за способом харчування - аутотрофи і гетеротрофи.
Аутотрофи (зелені рослини) здатні безпосередньо уловлювати сонячну енергію і використовувати її для створення органічних сполук.
Гетеротрофи – це організми, що асимілюють готові органічні речовини, які мають визначений запас потенційної енергії. У процесі їхньої життєдіяльності енергія вивільняється.
Великий художник, вчений і натураліст епохи ренесансу Леонардо Да Вінчі писав: «Життя можливе там, де може горіти вогонь». Іншими словами, процеси життєдіяльності здійснюються тільки при наявності енергії, отриманої при окиснюванні.
У живих організмах енергія, що вивільняється при окиснюванні, запасається, в основному, у виді хімічної енергії, що після використання переходить у теплоту.
При окиснюванні в неживій природі відбувається пряме приєднання Оксигену:
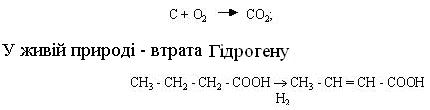
Такий процес можливий лише в тому випадку, якщо в реакційній суміші міститься речовина, що з'єднується з Гідрогеном, який вивільнився. Цю речовину називають акцептором Гідрогену, а сполуку, що є джерелом Гідрогену, – донором цього елемента. Універсальним акцептором Гідрогену виступає Оксиген повітря.
Загальна умова окиснювання – віддача електрона:
Fe2+ → Fe3+
–e
Процес вивільнення енергії в живому організмі забезпечує усі форми життєдіяльності (у тому числі перетворення речовин їжі в компоненти клітини), а також підтримку організму в стані динамічної рівноваги, незважаючи на постійні зміни умов зовнішнього середовища.
Типовим прикладом окиснювання в неживій природі є горіння. Воно супроводжується значним підвищенням температури. При горінні виділяється величезна кількість енергії, утворюється суміш різноманітних речовин непостійного складу. Характер виділення енергії, що з'являється при горінні, можна порівняти з нищівною силою водоспаду, що падає з високої гори. Якщо розділити його на кілька водоспадів, що падають з невеликої висоти, то кожний з них буде мати менший напір.
У процесі еволюції в живих організмах виробилися механізми перетворення могутнього потоку енергії, що вивільняється при повному окиснюванні харчових речовин, у невеликі порції, що запасаються, приблизно на 50 %, у виді хімічної енергії, використовуваної для процесів синтезу, інші 50% виділяються у виді теплоти.
Встановлено, що універсальним резервом хімічної енергії, що утворюється в процесі окиснювання органічних речовин у клітинах, є аденозинтрифосфат (АТФ). Ця сполука складається з аденіну, рибози і трьох залишків фосфорної кислоти. Таким чином, вивільнення енергії при окиснюванні органічних речовин, на відміну від горіння, відбувається поступово. При цьому не виникають ті значні перепади температури, що характерні для горіння. Незалежно від окремих етапів окисного розщеплення органічних речовин у кінцевому рахунку утворюються ті ж продукти розпаду (СО2 і Н2О) і виділяється стільки ж енергії.
Оксиген з повітря надходить в організм через дихальні шляхи в легені і кров, що транспортує його до всіх клітин. Однак Оксиген у тканинах не приєднується безпосередньо до вихідного джерела енергії – будь то Карбоген, амінокислота або жирна кислота. Ці сполуки поступово деградують, втрачаючи гідроген, електрони, що реагують з Оксигеном.
Таким чином, джерелом енергії в організмі стає реакція між Гідрогеном і Оксигеном, у результаті чого утворюється вода.
Оксид Карбогену, що є обов'язковим продуктом окиснювання, відщеплюється тканинними ферментами від кислотних груп – СООН, амінокислот, жирних кислот і ін.
На вивчення шляхів взаємодії органічних речовин і оксигену в клітинах були спрямовані зусилля багатьох дослідників, що висували гіпотези, які часом заперечували одна одній. Роль Оксигену для життя не викликала сумнівів. Задача полягала в тому, щоб з'ясувати, чому Оксиген повітря не окиснює організм і сам процес окиснювання відбувається тільки в тканинах, а не на шляху до них. Виявилося, що в тканинах відбувається активація Оксигену, яку потребує цей елемент для швидкої взаємодії з речовинами, що окиснюються (те ж спостерігається і поза організмом).
На рубежі XІ і XX ст. російський вчений А. Н. Бах і незалежно від нього в Німеччині К. Емглер і В. Вілд висунули гіпотезу про утворення пероксидів органічних сполук як початкового етапу біологічного окиснювання. Відповідно до цієї гіпотези молекула Оксигену переходить в активний стан за рахунок розриву в ній подвійного зв'язку за допомогою "внутрішньої коливальної енергії" самої сполуки, що окиснюється і при участі ферментів-оксидаз.
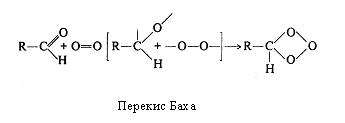
На початку XX сторіччя склалися дві концепції: біологічного активування Оксигену і активування Гідрогену. Однак протистояння їхніх прихильників продовжувалося недовго. У 1925 р. Д. Кейлін відкрив в аеробних біологічних об'єктах цитохроми, тобто ферменти, що дозволило вченим декількома роками пізніше зв'язати активування Оксигену і Гідрогену воєдино. Цьому сприяло виявлення О.Варбургом (1928 р.) цитохромоксидази, що називають "дихальним ферментом Варбурга". Саме цитохромоксидаза виявилася тим ферментом, що безпосередньо активує Гідроген, а цитохроми - ферментами, що "знімають" електрони у Гідрогену і передають їх цитохромоксидазі.
Сучасна теорія біологічного окиснювання об'єднала теорії Баха-Варбурга і Паладіна-Віланда на новому рівні розвитку досліджень цієї наукової проблеми. Отже, біологічне окиснювання – це процес відщіплення атомів Гідрогену або електронів від субстрату і передача їх через ряд проміжних етапів на молекулярний Оксиген. У цьому процесі беруть участь ферменти: пирідинозалежні дегідрогенази (їх коферментну функцію виконує нікотинамідаденіндинуклеотид-НАД або нікотинамідаденіндинуклеотидфосфат - НАДФ), флавінозалежні дегідрогенази – флавінові ферменти (до складу їхньої простетичної групи входить флавінаденіндинуклеотид – ФАД або флавінаденінфосфат – ФАДФ); цитохроми (містять у якості простетичної групи залізопорфіринову кільцеву систему), а також убіхінон (коензим Q) і білки, що містять негемінове залізо.
Роль окисНювально-відновних ферментів У біологічно-му окисНюванні.
Пірідинозалежні дегідрогенази. До цієї групи каталізаторів відносяться складні ферменти, небілковою частиною яких є НАД і НАДФ (рис.3). Останній відрізняється від НАД наявністю ще однієї молекули фосфорникотинамідаденіннуклеотидної кислоти.
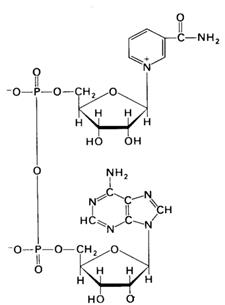
Рис. 3. Будова никотинамідаденіндинуклеотиду.
У клітинах НАДзалежні дегідрогенази беруть участь переважно в процесах, зв'язаних з переносом електронів від органічних субстратів до Оксигену.
НАД містить два залишки азотистих основ, залишки двох рибоз і двох фосфорних кислот. Однією азотистою основою є аденін, другою – амід нікотинової кислоти, якому властива функція вітаміну РР (антипелагричного). З назв азотистих основ і виникла абревіатура НАД.
Акцептором Гідрогену в НАД і НАДФ є нікотинамід в окисненій формі. В окисненій формі ця сполука містить у кільці п’ятивалентний Нітроген. Після відновлення один атом Гідрогену приєднується до Карбогену, у результаті чого розривається його подвійний зв'язок із сусіднім атомом. Електрон другого атома Гідрогену гасить заряд п’ятивалентного Нітрогену і той перетворюється в тривалентний. Приєднання електрону і зниження валентності є відбудовним процесом. Протон, що залишився, переходить у середовище.
Забираючи атоми Гідрогену від субстрату, нікотинамід переходить з окисненої форми у відновлену, і з акцептора Гідрогену стає його донатором.
Флавінозалежні ферменти (флавінові ферменти). Наступним акцептором атомів Гідрогену виступає група флавінових ферментів, що здійснюють його перенос (електронів і протонів) від відновленої форми НАД (НАДН2) до цитохромів. До флавінових дегідрогеназ відносяться складні ферменти, небілковою частиною яких є флавінаденіндинуклеотид (ФАД) (рис. 4). На відміну від нікотинамідаденін-динуклеотиду ФАД містить замість аміду нікотинової кислоти залишок вітаміну В2. Він з'єднаний з похідними рибози (рибітолом), двома залишками фосфорної кислоти, рибозою і аденіном.
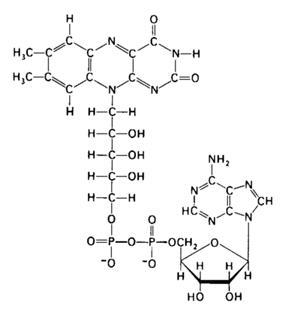
Рис. 4. Будова флавінаденіндинуклеотиду.
Гетероциклічне ядро вітаміну В2 є ізоалоксазином. Його сполуки називають флавінами, а білки, з'єднані з флавінами, – флавопротеїнами. До них відноситься фермент, що є дегідрогеназою, що реагує з НАДН2. Отже, цей флавопротеїн, як правило, не вступає в реакцію безпосередньо з органічними сполуками, що окиснюються, тому його називають вторинною дегідрогеназою. Разом з тим, є субстрати, що безпосередньо окиснюються флавопротеїнами. Вони транспортують відщиплені протони і електрони на Оксиген, і в результаті утворюється не вода, а оксид Гідрогену. Під впливом ферменту каталази він розщеплюється на воду і молекулярний Оксиген.
Крім ФАД, в окиснювально-відновних реакціях бере участь його фосфоролюване похідне – ФАДФ, що містить додатковий залишок фосфорної кислоти, приєднаний до рибози. В усіх цих сполуках вихідними речовинами є вітаміни, що повинні надходити в організм у складі їжі, щоб не порушився фундаментальний процес біологічного окиснювання – основне джерело енергії для процесів життєдіяльності.
Наступним ферментом, який каталізує перенос атомів Гідрогену від відновлених флавонуклеотидів, є кофермент Q, або убіхінон, сполука близька до вітаміну К.
Кофермент Q виступає посередником між ФАДН2 і цитохромами. Він являє собою похідне бензохінону з довгим бічним ланцюгом, що складається з 10 ізопреноїдних одиниць.
Відновлена форма флавінових дегідрогеназ у ланцюзі дихальних ферментів передає атоми гідрогену (електрони і протони) до Q. Приєднуючи гідроген, убіхінон з окисненої форми перетворюється у відновлену.
Подальший перенос електронів від відновленої форми убіхінону на Оксиген здійснює система цитохромів.
Цитохроми. Цитохроми (від грец. cytos – клітина, chroma – колір) –пігменти, пофарбовані в червоний колір завдяки наявності в їхній молекулі заліза. Встановлено, що в ланцюзі окиснювання ланка цитохромів включається у визначеній послідовності між убіхіноном і Оксигеном.
цит В → цит С1 → цит С → цит А → цит А3
Причому цитохроми В, С1, А1 виконують роль проміжних переносників електронів, а цитохром А3 (цитохромоксидаза) є кінцевим дихальним ферментом, що вступає в безпосередній контакт із Оксигеном. Усі цитохроми мають простетичну гемінову групу, ідентичну гему гемоглобіну.
Цитохроми відрізняються одне від одного не тільки простетичними групами. Розходження у властивостях окремих їхніх видів обумовлено будовою білкової частини. Так, у цитохромах В і С гем прикритий "ширмою" з пептидів, що перешкоджає їхній безпосередній реакції з Оксигеном. У ході каталітичного процесу валентність Феруму, що міститься в цитохромах, зворотно міняється (Fe2+ > Fe3+).
Окислена форма цитохромоксидази (Fe3+) приймає електрони від відновленого цитохрому С, переходячи у відновлену форму (Fe2+), що потім знову окиснюється в Fe3+ молекулярним Оксигеном на етапі цитохрому А3. При цьому утворюється активний Оксиген, що приєднує два протони з навколишнього середовища, у результаті чого і виникає молекула води.
У такий спосіб цитохроми завершують транспорт електронів від субстрату, що окиснюється, на Оксисен.
Дата добавления: 2015-10-05; просмотров: 1714;
