Уравнения материального и энергетического балансов
Иногда технологический процесс можно описать совокупностью уравнений (алгебраических, дифференциальных и др.). В модели включают уравнения, описывающие законы сохранения вещества и энергии, состояние среды и ее движение, равновесие, химическую реакцию, диффузию и др.
Рассмотрим уравнения материального и энергетического балансов.
Балансы могут быть составлены как для определенного конечного отрезка времени, так и для бесконечно малого промежутка времени (мгновенные балансы). Баланс первого типа может быть использован, например, для вычисления конечной концентрации углерода в сталеплавильной ванне по уравнению:
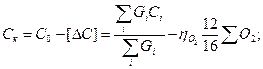 (7.1)
(7.1)
Здесь: 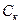 - конечная концентрация углерода, %;
- конечная концентрация углерода, %; 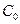 - начальная концентрация углерода, %;
- начальная концентрация углерода, %; 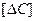 - количество углерода, выгоревшего за рассматриваемый промежуток времени %; Gi - масса i-той составляющей шихты, содержащей углерод, кг; Сi - концентрация углерода в i-той составляющей шихты, %;
- количество углерода, выгоревшего за рассматриваемый промежуток времени %; Gi - масса i-той составляющей шихты, содержащей углерод, кг; Сi - концентрация углерода в i-той составляющей шихты, %; 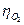 - коэффициент использования кислорода, доли;
- коэффициент использования кислорода, доли; 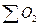 - количество кислорода, поступившее из различных источников, % от садки.
- количество кислорода, поступившее из различных источников, % от садки.
Баланс второго типа можно проиллюстрировать на примере уравнения, описывающего изменение объема проточной ванны идеального перемешивания [15, с.70 - 73]. Пусть в ванну в единицу времени поступает G1 объемных единиц жидкости (приток) и уходит из нее G2 единиц (сток). Тогда скорость изменения dV/dt объема ванны (скорость накопления) будет равна
dV/dt = G1- G2 (7.2)
Это и есть уравнение мгновенного материального баланса.
Если в ванну поступает раствор, содержащий два не взаимодействующих между собой вещества А и В, концентрации которых на входе равны СA1, и СB1, а на выходе - СA2, и СB2 то уравнения мгновенных материальных балансов для каждого компонента раствора записывают следующим образом:
(d/dt)(VСA2) = G1 СA1 - G2 СA2 (7.3)
(d/dt)(VСB2) = G1 СB1 - G2 СB2 (7.4)
Если же в ванне протекает химическая реакция A + B = C + D в результате которой в единицу времени расходуется Vс молей вещества A и Vс молей вещества В и образуется по стольку же молей каждого из веществ С и D, то в этом случае система уравнений материального баланса для данного процесса будет выражена следующим образом:
dV/dt = G1- G2(7.5)
(d/dt)(VСA2) = G1 СA1 – (G2 СA2 + Vс)(7.6)
(d/dt)(VСB2) = G1 СB1 – (G2 СB2 + Vс)(7.7)
(d/dt)(VСC2) = Vс - G2 СC2 (7.8)
(d/dt)(VСB2) = Vс - G2 СD2 (7.9)
Частным случаем энергетического баланса является тепловой баланс.
Пусть, например, в результате подвода тепла 1 кг какого-либо твердого вещества, имеющего температуру Т0, превращается в пар, нагретый до температуры Т. В этом случае поступившее тепло Q будет выражено так:
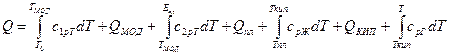 (7.10)
(7.10)
Здесь c1рт, c2рт, cрж, cрг - теплоемкости вещества в твердом, жидком и газообразном состояниях, Дж/(кг.К); Qмод, Qпл и Qкип — теплота перехода вещества из одной модификации (в твердом состоянии) в другую, а также теплоты плавления и кипения, Дж/кг.
Поскольку теплоемкости вещества являются функциями температуры, в выражения для вычисления 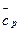 нужны среднеинтервальные теплоемкости;
нужны среднеинтервальные теплоемкости;
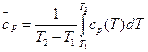 (7.11)
(7.11)
Если известны исходные данные, уравнение теплового баланса может быть, например, использовано для расчета конечной температуры вещества.
Кроме материального и энергетического балансов в физике известны и балансы других видов. В частности, для получения математического описания процесса может оказаться полезным рассмотрение баланса импульса потока. Используя это уравнение, Л. М. Ефимов [16] получил формулу для вычисления глубины внедрения жесткой струи газа в жидкость.
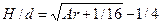 (7.12)
(7.12)
d –диаметр кратера, равный диаметру струи, м; Н - максимальная глубина проникновения струи, м; Ar – модифицированный критерий Архимеда, в котором линейный параметр заменен на d;
При больших значениях Ar это выражение имеет своим асимптотическим приближением известную формулу 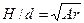 полученную также Л. М. Ефимовым на основании экспериментальных данных И. Г. Казанцева.
полученную также Л. М. Ефимовым на основании экспериментальных данных И. Г. Казанцева.
Дата добавления: 2015-10-05; просмотров: 1550;
