Коррозия основных металлических материалов
Коррозия железа и его сплавов. Железо является самым широко используемым металлическим материалом. С железными изделиями люди встречаются постоянно в своей жизнедеятельности, как в быту, так и на производстве.
По химической природе железо достаточно активный элемент (см. подраздел 1.4.1). Во влажной воздушной атмосфере, а также в различных водах, содержащих растворенный кислород, железо, как и многие металлы, подвергается разнообразным видам коррозии. Одна из наиболее распространенных, называется ржавлением. Это разрушение железа под действием кислорода и воды. Процесс ржавления относится только к коррозии железа и его сплавов. Наименование его связано с названием продуктов разрушения называемыми ржавчиной.
В химическом отношении разрушение железа протекает по следующей схеме:
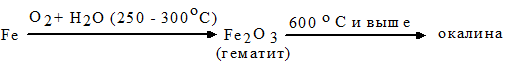
Образующая окалина представляет собой смесь нескольких оксидов железа: гематита Fe2O3, магнетита Fe3O4 и вюстита FeO.
Окалина далее переходит в гидроксид железа(II) Fe(OH)2. Последний легко окисляется в присутствии воды кислородом воздуха до гидроксида железа(III) Fe(OH)3. Это соединение, однако, очень неустойчиво, частично теряет воду с образованием вещества, описываемого формулой FeO(OH). Сложная смесь гидроксидов железа(II, III), продуктов их разложения и взаимодействия с агрессивными веществами окружающей среды, в том числе, оксидом углерода(IV) СО2, оксидами серы(IV) SO2 и серы(VI) SO3 и называется ржавчиной. Она имеет цвет от светло-коричневого до коричневого (бурого) и представляет собой рыхлое порошкообразное вещество. Коррозионные процессы железа, возникшие на его поверхности, проникают в толщу металла, так как образующая пленка очень рыхлая, содержит много трещин и пор. В них поступают влага, кислород и др. агрессивные среды. В морской воде разрушение осуществляется сильнее. Это связано с наличием в воде большого количества различных окислителей и усилителей коррозии, в частности галогенидов активных металлов, а именно их хлоридов. Разрушение углеродистых сталей в нейтральных средах носит равномерный характер и протекает практически с одинаковой скоростью. Она достигает нескольких десятых миллиметра в год в основном в природных условиях, а именно в незагрязненных атмосфере, морской и речной воде. В процессе эксплуатации, в частности при наличии электрических контактов и постоянной принудительной циркуляции воды скорость коррозии сталей высокая.
Щелочные растворы не оказывают разрушающего действия на углеродистые стали. В кислых средах, состоящих из кислот-неокислителей (фосфорная, угольная, уксусная, соляная и др.), данные сплавы корродируют с высокой скоростью. Концентрированные растворы кислот-окислителей, а именно, серной и азотной, не действуют на углеродистые стали.
Стабильность по отношению к коррозии определяется также типом обработки данных сплавов. Отожженные среднеуглеродистые стали (0,3 - 0,4 % С) являются уже значительно коррозионностойкими по сравнению с не обработанными сплавами. Достаточно небольшие концентрации постоянных примесей сталей (0,6 - 0,8 % марганца Мn; 0,30 - 0,35 % кремния Si; 0,04 % фосфора Р и 0,02 % серы S) - неопасны. Однако увеличение количества марганца Mn, фосфора Р и серы S, уменьшает лишь механическую прочность сталей, но не сказывается на коррозионной стойкости.
Особенно коррозии железа очень часто способствует присутствие в нем и его сплавах серы. Сера содержится в виде сульфидов железа и марганца, не растворимых в a-железе при комнатной температуре. Красноломкость наступает при горячей деформации стали вследствие расплавления сульфида железа в g-железе (988 °С), расположенного по границам зерен. От этого сплав предохраняет марганец, который связывает серу в соответствующий тугоплавкий сульфид (Тпл = 1620 °С). Однако одновременно сульфид марганца нарушает однородность в структуре сплава, снижает его пластичность и вязкость, усталостную прочность, ухудшает свариваемость и коррозионную стойкость. Все это связывается с усилением полосчатости ферритно-перлитного строения из-за вытянутости сульфидов. В жаропрочных сталях повышение концентрации серы заметно уменьшает пределы ползучести и длительной прочности. Содержание серы допускается не более 0,06 %.
Под совместным действием нагрузок и агрессивных сред (концентрированных растворов и расплавов щелочей, кипящих водных растворов хлоридов и цианистоводородной кислоты HCN) в углеродистых сталях происходит коррозионное растрескивание. Данное явление также наблюдается в этих сплавах при высоких концентрациях азота.
Углеродистые стали с концентрацией меди до 0,5 % коррозионностойки на воздухе и в щелочных растворах.
Низко- и среднелегированные конструкционные стали являются теплостойкими, жаропрочными и жаростойкими; высоколегированные - кроме того и коррозионностойкими.
Атмосферостойким материалом является низкоуглеродистая и низколегированная сталь, содержащая в своем составе (%): 0,12 С; 0,30 - 0,80 Мn; 0,25 - 0,70 Si; 0,50 - 1,20 Сr; 0,30 - 0,60 Ni; 0,30 - 0,55Cu; 0,07- 0,15 Р; не более 0,04 S и не менее 0,01 Аl. В атмосфере средней загрязненности коррозионная стойкость этой стали приблизительно на 50 % выше стабильности обычных углеродистых сталей. В процессе первых двух лет эксплуатации на поверхности изделий из атмосферостойких и низколегированных сталей иногда образуются участки сульфатов. Через три года работы деталей продукты коррозии достаточно богаты серой, и ее концентрация на поверхности и во всем объеме практически одинакова. При постоянной эксплуатации в продуктах коррозии по толщине слоя также увеличиваются концентрации хрома, меди и фосфора, что способствует естественной защите материала и изделий. Сформировавшая в данном случае защитная пленка имеет высокую адгезию (сцепляемость) с поверхностью металла и практически не осыпается.
На открытом воздухе и в закрытых и полузакрытых помещениях одной и той же местности коррозионная стойкость таких сталей различна. В первом случае, а именно в 2 раза, они более стойки, чем во втором. В высокоагрессивной атмосфере преимущества этих материалов перед обычными углеродистыми сталями не заметны.
Самыми востребованными из высококоррозионностойких железоуглеродистых сплавов являются нержавеющие стали, содержащие в качестве основного легирующего компонента хром. Концентрация хрома в хромистых сталях не менее 12 - 18 %. Высокая коррозионная стабильность достигается за счет сформировавшейся на поверхности материала или изделия защитной пленки оксида хрома(III) Сr2O3, придающей стали зеленовато-голубоватый оттенок. Данные сплавы являются низкоуглеродистыми (не более 0,45 %). Чем меньше концентрация углерода, тем выше антикоррозионные свойства сталей.
Коррозионностойкими являются стали ферритного класса 08Х13, 12Х17, 08Х25Т, 15Х28. Однако они предрасположены к межкристаллитной коррозии (по границам зерен) из-за обеднения хромом границ зерен. Для предотвращения этого в них добавляют титан (до 0,5 %). Введение в стали никеля, молибдена, меди приводит к улучшению технологических свойств, а также их защитных свойств.
Хромистые стали обладают повышенной стойкостью к щелевой коррозии в нейтральных и слабокислых средах. Однако они подвержены точечной коррозии в нейтральных хлоридосодержащих средах в присутствии окислителей. Чем выше концентрация хрома в них, тем более устойчива сталь по отношению к кислотам.
Жаростойкость (окалиностойкость) - это способность металлов и сплавов сопротивляться газовой коррозии при высоких температурах в течение длительного времени.
Окалиностойкость зависит от концентрации легирующих добавок. Например, чем больше хрома в составе сталей, тем они более жаростойки. Так сталь 15Х25Т устойчива до 1100 - 1150 °C.
Высокой жаростойкостью обладают хромокремнистые 40Х10С2М, 40Х9С2, Х6С и стали 08Х17Т, 36Х18Н25С2, 15Х6СЮ.
Из сплавов аустенитного класса наиболее устойчивыми к коррозии являются высоколегированные хромоникелевые стали, например, 04Х18Н10, 12Х18Н9Т. Из-за дефицитности никеля его концентрацию снижают, и дополнительно вводят марганец (40Х14Г14Н3Т) или азот (10Х20Н4АГ11), как заменители. Стали 0Х21Н5Т, Х21Н5Т, 0Х22Н5Т, 0Х21Н6М2Т относятся к кислотостойким, а Х14П4Н3Т, Х14Г14Н, Х17Г9АН2 и Х17АГ14 являются нержавеющими (ГОСТ 5632-72).
В незагрязненных атмосфере, воде и почве хромоникелевые стали, например, 18Cr8Ni обладают высочайшей коррозионной стойкостью. Но в хлоридсодержащих средах они подвержены локализованным видам коррозии. Наиболее стойки к щелевой и точечной коррозии молибденосодержащие стали.
Хромоникелевые стали являются материалами с повышенной кислотостойкостью. Однако их стабильность при увеличении кислотности среды (рН намного ниже 7) снижается. Азотная кислота ни при каких условиях не вызывает коррозии этих сплавов. По отношению к соляной кислоте независимо от ее концентраций хромоникелевые стали крайне не устойчивы. Щелочные среды не опасны для сталей этого класса вплоть до 400 - 800 °С. Коррозионностойкие высоколегированные хромом, никелем и кремнием стали применяют до 1000 °С. Жаропрочные аустенитные стали с добавками хрома, никеля и молибдена используют до 700 °С.
Сплавы данного класса также как и хромистые склонны к межкристаллитной коррозии. Очень резко она обнаруживается в процессе долговременной эксплуатации в температурной области 500 - 800 °С, особенно при 600 - 650 °С. Максимальная межкристаллитная коррозия для стали типа 18-8 с концентрацией углерода 0,08 % соответствует 100-часовой выдержке при 650 °С. Данный вид разрушений аустенитных коррозионностойких сплавов также определяется размерами его зерен. Стабильность сталей понижается при росте размеров зерен и увеличении плотности карбидов хрома на поверхности.
Низкоуглеродистые аустенитные стали типа 000Х18Н11 с концентрацией углерода менее 0,03 % высокоустойчивы не только к межкристаллитной и ножевой коррозии, но и к разрушениям в окислительных средах. Антикоррозионные свойства таких сплавов в 15 раз превышают стабильность стали 0Х18Н10Т.
В хромоникелевых сталях, как и у всех пассивирующихся металлических материалов, под действием окислителей и ионов хлора отмечаются точечные (и щелевые) разрушения. Они концентрируются в одной области и являются следствием повреждения равномерности защитного слоя. Нарушение пассивного состояния происходит в результате замещения ионов кислорода катионами хлора в составе оксида.
Коррозионное растрескивание сплавов этого класса наблюдается при совместном воздействии напряжений и водных растворов хлоридов s-металлов I и II групп или щелочей при высоких температурах. Хромоникелевые стали с концентрацией никеля от 30 до 40 % имеют низкую устойчивость к данному виду разрушений. Повышенные антикоррозионные свойства по отношению к органическим кислотам, восстановительным и других средам, а также точечным и щелевым повреждениям имеют стали Х17Н13М2Т (Х18Н12М2Т) и Х17Н13М3Т (Х18Н12М3Т) с 3 - 4 % молибдена в их составе. В морской воде точечная коррозия этих сталей развивается в 10 раз медленнее (0,18 мм/год) чем сплавов Х17 и Х18Н9 (1,75 мм/год).
К коррозии под напряжением и коррозионному растрескиванию более стойка сталь 0Х23Н28М2Т по сравнению со сплавом 0Х23Н28М3Д3Т.
Деформируемая аустенитная сталь 00Х18Н20С3М3Д3Б, в состав которой дополнительно введен кремний, устойчива в сильно агрессивных средах, в том числе и в серной кислоте. В фосфорной кислоте любой концентрации до 90 °С наиболее стойкой является низкоуглеродистая сталь 00Х21Н21Н4Б.
Помимо нержавеющих сталей используют коррозионностойкие сплавы на основе никеля. Высоконикелевые хастеллои содержат до 80 % никеля, в качестве легирующего компонента используется молибден. Его концентрация составляет от 15 до 30 %. Данные сплавы обладают стабильностью в сильных кислых средах, в частности, в кипящих ортофосфорной Н3РО4 и соляной кислотах HCl.
Серый чугун из-за высокой концентрации углерода в его составе обладает более низкими антикоррозионными свойствами по сравнению с углеродистыми сталями.
По типу легирующего элемента чугуны бывают: никелевые (2 -5 % Ni), хромистые (26 - 30 % Сr), алюминиевые (чугаль); высококремнистые (ферросилиды); кремнемолибденовые (антихлоры); хромоникелемедистые (нирезисты); хромоникелекремнистые (никросилалы) и некоторые другие.
Широкоприменяемыми являются ферросилиды С15 и С17. Их высокие антикоррозионные свойства обусловлены наличием на поверхности защитной пленки. Они высокоустойчивы даже в горячих растворах кислот: серной, фосфорной, азотной и хромовой, в холодной разбавленной соляной, а также в органических. Плавиковая кислота и щелочи растворяют ферросилиды.
В серной и азотной кислотах наиболее антикоррозионны кремнистые чугуны (14 - 16 % кремния Si). Данные сплавы, легированные молибденом (3 - 4 %), устойчивы по отношению к соляной кислоте. Для всех типов чугунов наблюдается низкая стабильность к растрескиванию при механических и тепловых ударах. Совместно с ферросилидами антихлоры (кремнемолибденовые сплавы) относятся к особо коррозионностойким сплавам.
Концентрация углерода и хрома в хромистых чугунах соответственно составляет 2,5 - 3,0 % и 25 - 30 %. Данные сплавы достаточно устойчивы в растворах азотной кислоты. С повышением концентрации хрома, а именно до 40 - 45% стабильность чугунов возрастает. Широкое применение имеют из них сплавы Х28Л и Х34Л. Легирование хромистых чугунов кремнием увеличивает окалиностойкость и улучшает механические свойства, медью - повышает их коррозионную стойкость в восстановительных средах.
Чугали также относятся к сплавам с высокой окалиностойкостью и повышенной прочностью при высоких температурах. Хромоникелевые чугуны, а также нирезист и никросилал являются коррозионностойкими.
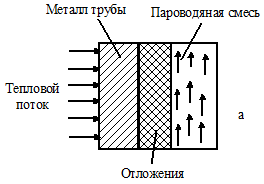
Коррозия чугунных труб и поверхностей котлов осуществляется в процессе эксплуатации при соприкосновении их с водой и кислородом при высоких температурах. Повреждение экранной трубы начинается с образования на ее наружной поверхности типичных поперечных рисок. Их глубина достигает до 0,45 мм (рис. 1.103).
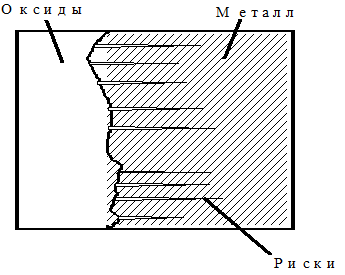
Рис. 1.103 - . Обычное повреждение экранной трубы из стали 12Х1МФ
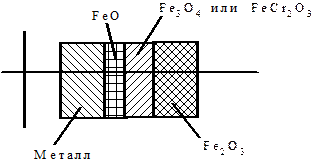
В результате окисления железа на металлической поверхности этих изделий происходит формирование различных оксидов и хромата железа - хромистой шпинели (рис. 1.104 - 1.107). 300 - 400 г/м2 - это максимальное значение концентрации оксидов железа, способствующей образованию дефектов.

| 
|
| Рис. 1.104 - Коррозия труб поверхностей нагрева котлов с газовой (наружной) стороны | Рис. 1.105 - Строение защитного слоя оксидов на наружной поверхности труб |
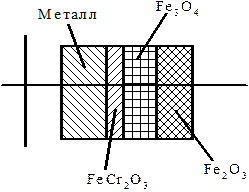
Далее на внутренней поверхности труб под пленкой продуктов коррозии при постоянном взаимодействии с котловой водой созревает подшламовая коррозия.

| 
|
| Рис. 1.106. Строение защитного слоя оксидов на поверхностях труб из стали 12Х18Н12Т: FеСг2О3 - на внутренней, Fe3O4 - на наружной | Рис. 1.107. Защитный слой оксидов на наружной стенке трубы из стали 12Х1МФ, контактирующей с продуктами сгорания природного газа |
В ходе ее развития происходит образование язв. В них откладываются продукты разрушений, вследствие чего язвы практически не видны (рис. 1.108). В процессе роста язвы переходят в свищи. Данная коррозия относится к электрохимической.
| 
| 
| |
| 
| ||
|
Рис. 1.108. Схема развития подшламовой коррозии на внутренних поверхностях труб
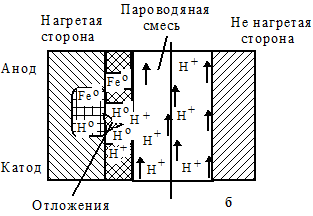
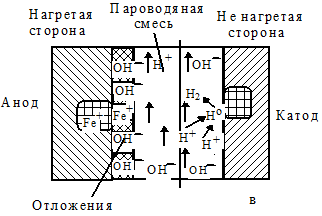
В стенках труб под действием горячей пароводяной смеси вследствие термического сопротивления продуктов коррозии и металла создается разница температур. Через толстую неплотную пленку оксидов раствор выпаривается, вызывая увеличение концентрации солей (рис. 1.108а). При рН меньше 7,0 лимитирующими являются процессы восстановления ионов водорода, формирующихся при диссоциации котловой воды, на катодных областях и растворения образующегося водорода в металле. При этом регистрируется его насыщение и усиленное повреждение (рис. 1.108б). Растворенный в стали атомарный водород вызывает снижение прочности и пластичности. При высоких температурах он уменьшает длительную прочность и ускоряет ползучесть. Это явление называется водородной хрупкостью (охрупчивание). При рН больше 7,0 формирование водорода происходит медленно. Образующийся водород вливается в пароводяную смесь. Поэтому охрупчивание чугуна приостанавливается и имеет место лишь общая коррозия (рис. 1.108в).
Обычно топливо содержит серу, концентрация которой в нем очень высокая. Сжигание этого топлива вызывает низкотемпературную сернистую коррозию поверхности нагрева оборудования, стальных коробов газоходов и дымовых труб. В процессе сгорания мазута и углей осуществляется окисление серосодержащих органических соединений, которое приводит к формированию оксида серы(IV) SO2 (сернистого газа) по реакции (1.26).
2H2S + 3О2 = 2SO2 + 2Н2О (1.26).
Далее с повышением температуре (400 - 1400 °С) образующийся оксид серы(IV) SO2 под действием кислорода превращается в оксид серы(VI) SO3 - серный газ (уравнение 1.27).
2SO2 + 2О2 = 2SO3 (1.27).
Сформировавшиеся газы вместе с пароводяной смесью при передвижении по газовому тракту котла охлаждаются. В процессе перемещения происходит их взаимодействие с образованием серной кислоты (реакция 1.28).
2SO3 + 2Н2О = H2SO4 (1.28)
В точке росы кислотных паров полностью завершается процесс формирования серной (H2SO4) кислоты. Она оседает на поверхностях нагрева оборудования и вступает в реакцию с металлом, переводя его в сульфаты железа(III и II) Fe2(SO4)3 и FeSO4.
Коррозионная стойкость цветных металлов и их сплавов определяется положением металла в периодической системе, знаком и значением электродного потенциала и способности к пассивации.
Коррозия алюминия и его сплавов. В химическом отношении алюминий является одним из активных металлов, поэтому уже при нормальных условиях легко взаимодействует с кислородом О2 с образованием его оксида Аl2O3. Последний тонкой пленкой располагается на поверхности металла и защищает его от дальнейшего разрушения. Она обладает удивительным качеством, при случайном и незначительном повреждении пленка мгновенно самовосстанавливается. Поэтому ее толщина на поверхности металла составляет от 5·10-6 до 1·10-5 мм. Такая оболочка достаточно прочная, твердая, гибкая, не отстает при растяжении, закручивании, изгибе, сжатии, а также придает поверхности металла красивый матовый цвет. Поэтому алюминий является устойчивым по отношению ко многим агрессивным средам. Его стабильность к коррозионным процессам в двадцать раз превышает коррозионную стойкость сталей. Например, алюминиевая кровля металлургических цехов, атмосфера которых насыщена сернистым газом SO2, за двадцать лет разрушается всего лишь на 0,11 мм. За это время стальную крышу пришлось бы менять не один раз. Сероводород H2S, сернистый газ SO2, аммиак NH3 и другие газы, присутствующие в воздухе, не вызывают повреждений алюминия при нормальных условиях, а пар, дистиллированная и чистая пресная вода - даже при высоких температурах (до 180 - 200 °С). В морской атмосфере, а также на расстоянии около 1,2 км до морского побережья алюминий подвергается точечной коррозии.
В нейтральных средах алюминий чаще всего подвергается местной коррозии, нередко приводя к сквозным повреждениям, а в кислых растворах разрушения носят равномерный характер.
Алюминиевые материалы, не содержащие в своем составе меди, достаточно стабильны по отношению к естественной (не загрязненной) морской воде. Поэтому морские бакены, корпуса спасательных шлюпок, судов и барж производятся из таких алюминиевых материалов. Сернокислые соли (сульфаты) натрия и магния, а также их гипосульфиты на технический алюминий не действуют. Однако при наличии в воде компонентов, разрушающих оксидную пленку, т. е. взаимодействующих с оксидом алюминия, в частности солей ртути, меди, хлоридов металлов и др. начинается процесс коррозии, который развивается довольно быстро. Например, присутствие солей ртути вызывает окисление алюминия с одновременным образованием свободной ртути, которая образует с металлом сплав, называемой амальгамой. Он располагается на поверхности алюминия в виде пленки, плохо сцепленной с ней, разрушающий оксидную пленку и не защищающий его от дальнейшего разрушения агрессивной атмосферной средой, в том числе, воды и др. компонентов. Так металл при этом реагирует с водой с бурным выделением газообразного водорода Н2 и образованием гидроксида алюминия Al(OH)3. Такой же эффект наблюдается при снятии оксидной пленки Аl2O3 с поверхности металла, а именно при зачищении ее наждачной бумагой или полотном.
Стабильность алюминия по отношению к коррозии определяется степенью его чистоты. Наиболее коррозионностойким является самый чистый металл.
Технический алюминий, покрытый пленкой оксида Аl2O3, не разрушается под действием различных кислот. Из органических кислот он устойчив по отношению к уксусной, лимонной, масляной, винной, яблочной и пропионовой, а также кислым фруктовым сокам и вину. Однако щавелевая и муравьиная кислоты реагируют с оксидом алюминия, а потом и с самим металлом. В нормальных условиях металлические алюминиевые материалы не взаимодействует c концентрированными азотной HNO3 и серной H2SO4 кислотами. Имеющая пленка оксида алюминия в данном случае увеличивается по толщине, и не растворяется в данных кислотах. Поэтому в алюминиевых цистернах, баках и др. таре транспортируют и хранят данные кислоты. Однако в растворах таких кислот, как фторо-, хлоро- и бромоводородные (HF, HCl, HBr) и разбавленной (< 10 %) серной H2SO4 алюминий окисляется, так как с ними активно взаимодействует оксид алюминия. В ходе реакций с этими кислотами алюминий бурно вытесняет из них ионы водорода, восстанавливая его до газообразного водорода, сам металл окисляется до формирования соответствующих солей. Взаимодействие с разбавленными растворами азотной кислоты HNO3 не сопровождается выделением водорода, он окисляется с образованием воды. В ходе него азотная кислота в зависимости от концентрации восстанавливается до различных оксидов азота и формирования нитрата алюминия Al(NO3)3.
Коррозионная стойкость алюминиевых материалов также определяется их состоянием. Высокой она является у слитков, брусков и др. твердых алюминиевых предметов. Однако у порошкообразного и фольгированного алюминия устойчивость крайне мала. Например, такой алюминий быстро сгорает в среде кислорода.
Водные растворы щелочей разной концентрации разрушают алюминиевые материалы и изделия полностью с достаточно большой скоростью. Так водный раствор едкого натрия NaOH (концентрация 0,1 %), окисляет алюминий со скоростью - 16 мм в год с образованием растворимых алюминатов; 0,1 % карбоната натрия (соды) Na2CO3 - 0,4 мм в год. Это вновь связано с растворением оксида алюминия в этих соединениях. Реакция со щелочами протекает с бурным выделением водорода, и очень долгое время применялась для его промышленного получения.
Как уже было отмечено растворы аммиака на алюминий, а особенно на сплавы, содержащие магний (магналии и др.), не действует. Незначительно эти материалы разрушаются и под действием различных аминов. Алюминиевые материалы достаточно стойки также и по отношению большинства пищевых продуктов. Известно, что алюминий обладает свойством не разрушать витамины. Поэтому оба эти факта позволяют широко применять его в производстве посуды.
Алюминиевые материалы стабильны по отношению к почвенной (подземной, грунтовой) коррозии. Следствие этого является использование алюминиевых материалов для производства труб, применяемых в сооружении подземных трубопроводов. Алюминий и его сплавы устойчивы при действии на них бетона, строительных растворов, штукатурки особенно без частого контакта с водой и атмосферной влаги. В связи с этим данные материалы употребляются в строительном деле. Из них производят двери, оконные рамы, облицовочные панели и электрические кабели.
Алюминиевые материалы даже в нормальных условиях взаимодействуют с хлором Cl2 и бромом Br2, а при повышенных температурах реагируют с такими неметаллическими соединениями как азот N2, фтор F2, углерод C, сера S, водород H2 и йод I2. Так водород хорошо растворяется в алюминии и приводит к образованию пор при литье. Азот реагирует с алюминием с формированием тугоплавкого нитрида AlN. Алюминий и его сплавы также не стойки по отношению к различным альдегидам, в частности, формалину, уксусному альдегиду и др. Из всех алюминиевых материалов по коррозионной стойкости технический металлический алюминий занимает первое место. Далее следуют сплавы. Из них наиболее коррозионно-устойчивыми являются алюминиево-магниевые сплавы, а также системы, не содержащие в своем составе медь. Магналии в основном стабильны по отношению к пресной и морской воде, а также при контакте с азотной, разбавленной серной и ортофосфорной H3PO4 кислотами и сернистым газом SO2. На самом последнем месте по коррозионной стойкости располагаются дюралюмины сплавы, в составе которых содержится до 6 % меди. Данные сплавы более всего подвергаются межкристаллитной коррозии. Высокая степень повреждений дюралюминов связана с тем, что в ходе их термической обработки из твердого раствора меди в алюминии (структура сплава) выделяются кристаллиты интерметаллидного соединения этих металлов. Последние образуют с алюминием гальванические микропары, которые и являются причиной точечной коррозии. Силумины и авиали по коррозионной стабильности располагаются в промежутке между магналиями и дюралюминами.
Присутствие железа, как в алюминии, так и в его сплавах является вредной примесью. Оно значительно уменьшает их коррозионную стойкость. Опасен также контакт алюминиевых материалов и изделий со стальными деталями (болты, заклепки, гвозди и др.). Оба эти факта связаны с возникновением гальванических пар Al-Fe, где алюминий как более активный подвергается электрохимической коррозии. Для алюминиевых материалов значительно опасны отложения сажи и пыли.
Разрушения медных металлических материалов. Медь по химическим свойствам достаточно инертна, а значит и более стойка в агрессивных средах. Ее стабильность по отношению к коррозии в сравнении с железом и его сплавами намного выше.
В сухом чистом воздухе медь не подвергается коррозии. Из неорганических газов она легче всего взаимодействует при обычной температуре с галогенами (фтором F2, хлором Cl2 и бромом Br2) с образованием соответствующих галогенидов Cu(II). Данные газы и жидкость способствуют интенсивному разрушению меди во влажной атмосфере. В ходе реакции с йодом происходит формирование иодида меди(I) CuI. С кислородом и серой металл реагирует только при нагревании. Большее сродство медь проявляет к сере. Она сгорает в парах серы с образованием сульфида CuS. Наличие серы в чистом металле обуславливает его хладо- и красноломкость, которые вызывают повреждения при механической обработке, в том числе и прокатке. С кислородом при температуре красного каления медь окисляется до черного оксида CuO, а при более высокой - до ярко-красного Cu2O. С водородом Н2 и углеродом С медь не взаимодействует. Металлические медные материалы и изделия достаточно устойчивы по отношению как к чистой пресной, так и морской воде. Они также не реагируют с растворами щелочей и солей активных металлов при нормальных условиях. При повышении концентрации щелочей в контактирующей с металлом среде выше 50 % и температуре более 80 °С могут начаться разрушительные процессы. Однако металл и его сплавы плохо сопротивляются действию аммиака, аммиачных солей, в частности хлористого аммония, и щелочных цианистых соединений вследствие протекания процессов комплексообразования. При этом на них протекает межкристаллитная коррозия. На химическую стойкость меди влияют органические кислоты, фенольные смолы и спирты оказывают на них незначительные воздействия. По отношению к разбавленным неорганическим кислотам, таким как фторо- HF (плавиковая), хлоро- HCl (соляная) и бромоводородной HBr, а также серной H2SO4, ортофосфорной H3РO4 и др. металл является устойчивым. Он корродирует лишь в кислотах-окислителях: концентрированной H2SO4 (продукты: сульфат меди CuSO4, оксид серы(IV) SO2 и вода Н2О) и азотной НNО3 (любой концентрации). Азотная кислота в зависимости от концентрации восстанавливается до соответствующих оксидов: N2O, NO, NO2 и формирования нитрата меди Cu(NO3)2. При контакте медных материалов и изделий с влажной воздушной атмосферой, содержащей диоксид углерода СО2, их поверхность покрывается плотной серо-зеленой пленкой основного карбоната - Cu(OH)2·CuCO3 - малахита. Оксид серы(IV) SO2 совместно с кислородом и водой приводит к формированию на медной поверхности слоя основного сульфата меди - 6Cu(OH)2·CuSO4 - патины, окрашивающего ее в зеленовато-синий цвет. При дальнем развитии повреждения патина переходит в брохантит 3Cu(OH)2·CuSO4. В условиях морской атмосферной влаги на поверхности медных материалов и изделий формируется ярко-зеленая пленка основного хлорида меди 3Cu(OH)2·CuCl2. Все три пленки достаточно тонкие, и являются защитными по отношению к металлу.
Все сплавы меди относятся к достаточно коррозионно-устойчивым материалам. Сплавы медь-олово обладают высокой коррозионной стойкостью в атмосферных условиях, в сухом и влажном водяном паре, в пресной и морской воде, в сухих газах, кислороде и кислотах при нормальной температуре. Однако все оловянные бронзы быстро разрушаются под воздействием рудничных вод, содержащих соли-окислители, и в растворах аммиака. Скорость коррозии сплавов в газах и кислотах возрастает при высоких температурах, а также в присутствии хлора, брома, йода, во влажном сернистом газе SO2. Значительное влияние на свойства сплавов медь-олово оказывают примеси. Так присутствие железа Fe более 0,2 - 0,3 % резко снижает их антикоррозионные свойства. Хром Cr, селен Se и мышьяк As также ускоряют окислительные процессы. Никель Ni увеличивает коррозионную стойкость и уменьшает ликвацию. Наряду с никелем усилению их антиокислительной стабильности способствуют также бериллий Be, цинк Zn, алюминий Al, кремний Si и кадмий Cd. Алюминиевые бронзы (до 12 % Al) коррозионноустойчивы в атмосферных условиях, углекислых растворах, морской воде, а также в органических кислотах (лимонной, уксусной и молочной). Однако при длительной эксплуатации в щелочных растворах, а также солевых (хлоридов и сульфатов) отмечается их избирательная коррозия. С целью увеличения коррозионной стойкости в них чаще всего добавляют еще никель или марганец. Кремнистые бронзы (до 3,5 % Si) достаточно устойчивы в пресной и морской воде, в атмосфере сухих газов: сернистого SO2, хлора, брома, фтора, фтористого HF и хлористого водорода HCl, аммиака NH3, а также кислот. Они являются самыми коррозионноустойчивыми из всех бронз. В присутствии влаги и повышении температуры их коррозионная стойкость резко снижается. Так при температурах до 300 °С они устойчивы к перечисленным соединениям. Оловянистые и алюминиевые бронзы выдерживают еще более высокую температуру, а именно, становятся активными лишь при 700 °С. В нормальных условиях они удовлетворительно сопротивляются воздействию разбавленных растворов щелочей. Сплавы корродируют в кислых рудничных водах, содержащих сернокислую окисную соль железа, а также в растворах солей хромовых кислот (H2CrO4, H2Cr2O7) и хлорного железа FeCl3. Бериллиевые бронзы также относятся к высококоррозионностойким материалам. Однако при совместном действии влажной атмосферы и больших нагрузок в них регистрируется коррозионное растрескивание. Бронзы и медноникелевые сплавы слабо подвергаются почвенной коррозии.
Атмосферные условия, сухой пар, пресная и морская вода, сухие газы, уксусная кислота в спокойном состоянии, сухой четыреххлористый углерод, фторированные органические соединения, хлористый метил и бромозамещенные соединения при отсутствии влаги не вызывают заметной коррозии латуней. Но они сильно корродируют при действии азотной, соляной, фосфорной и жирных кислот, рудничных вод, растворов йодистых солей, серного ангидрида, сероводорода, растворов едких щелочей и аммиака. При высокой температуре в морской и пресной воде, а также в газах с увеличением их влажности скорость разрушения латуней быстро возрастает. Некоторые медные сплавы подвержены селективной коррозии и коррозионному растрескиванию. Селективная коррозия заключается в обеднении латуней и бронз вторым металлическим компонентом (цинком, оловом и алюминием). Коррозионное растрескивание наблюдается при одновременном воздействии коррозионной среды и растягивающих напряжений. Склонность сплавов к данным видам разрушений возрастает с повышением концентраций легирующих добавок и с увеличением до известного предела растягивающих напряжений. Сплавы, содержащие не более 5,0 % этих металлов наименее чувствительны к ним. При хранении во влажной атмосфере сплавы, в большей степени латуни, также могут подвергаться коррозионному растрескиванию. Степень влажности атмосферы в данном случае играет большую роль. Коррозионное растрескивание проявляется во все времена года не одинаково интенсивно, поэтому его иногда называют «сезонным растрескиванием». Данные вид разрушений обычно происходит в присутствии аммиака NH3, паров ртути Hg, растворов ее солей, в сильно загрязненной атмосфере.
Специальные латуни обладают более высокой коррозионной стойкостью по сравнению с простыми медноцинковыми сплавами. Алюминиевые латуни достаточно стойки по отношении к атмосферной коррозии, но менее устойчивы к морской воде. Однако они очень сильно подвержены коррозионному растрескиванию. Кремнистые латуни также обладают более высокой коррозионной стойкостью в атмосферных условиях и морской воде. Стойкость марганцовистых латуней значительно выше к воздействию хлоридов, морской воды и перегретого пара. Но они весьма значительно склонны к коррозионному растрескиванию. Никелевые латуни имеют хорошую коррозионную стойкость в атмосферных условиях, морской воде и в условиях бактериологической коррозии, а также у них резко уменьшается предрасположенность к коррозионному растрескиванию. Стойкость латуней к морской воде резко увеличивается при введении в них от 0,5 до 1,5% олова Sn «морские латуни». Примесь мышьяка при концентрации до 0,02 % предохраняет латуни от обесцинкования, повышая тем самым коррозионную стойкость их в морской воде. Однако присутствие сурьмы увеличивает склонность латуней к коррозионному растрескиванию.
Мельхиоры с примерным составом - 68,0 % меди, 30,0 % никеля, 1,0 % марганца и 1,0 % железа - обладают высокой коррозионной стойкостью в пресной и морской воде, сухих газах и в атмосферных условиях, они хорошо противостоят действию концентрированных щелочных растворов при 80 °С и органических соединений. На воздухе нейзильбер не окисляется и достаточно стоек в растворах солей и органических кислот. Медноникелевые сплавы (концентрация никеля до 15 %) являются коррозионностойкими по отношению к хлороводородной (соляной HCl) кислоте, проточной морской воде, аммиачному растрескиванию.
Все медные сплавы сильно подвержены коррозии под действием перекиси водорода Н2О2, расплава серы, сероводорода H2S и серного газа SO3.
Коррозия титана и его сплавов. При нормальных условиях на воздухе титан высококоррозионностоек, а именно, практически не разрушается. С повышением температуры активность титана возрастает. Нагретый до красного каления он сгорает в кислороде с образованием оксида TiO2 (рутил). При 200 - 400 °С взаимодействует с галогенами с образованием галогенидов TiHal4. С азотом металла реагирует еще при более высокой температуре (800 °С), восстанавливаясь до нитрида TiN. Титан химически стоек во многих агрессивных средах, в частности в воде, как в холодной, так и кипящей, пресной и морской. Его стабильность в морской воде превышает устойчивость всех металлов, кроме драгоценных - золота, серебра, платины и т. д., а также большинства нержавеющих сталей, медных никелевых и др. сплавов. Титан также стабилен по отношению к сульфатам, хлоридам, неорганическим и органическим кислотам, их смесям и щелочам.
Такие высокие антикоррозионные свойства титана связаны с наличием на его поверхности плотной однородной защитной пленки, состав которой зависит от природы окружающей среды и условий ее формирования. Чаще всего это оксид титана(IV) - TiO2. Пленка рутила очень тонкая, она имеет высочайшее сцепление с металлом. Оксид титана химически инертен. Титан обладает интересным свойством, а именно, при снятии слоя оксида, в любой окислительной среде, в которой присутствует кислород или такие окислители как азотная, или хромовая кислоты, она вновь образуется очень быстро и далее защищает металл от повреждений. В некоторых случаях поверхность металла может быть покрыта тонким слоем гидрида TiH2, который также является защитным. Хлористоводородная HCl (соляная) кислота не действует на титан лишь в разбавленном виде (от 5 до 10 %). При нагревании до 60 °С скорость реакции сильно повышается. В данном случае кислота вначале взаимодействует с оксидом титана, растворяя его полностью, а уже потом происходит реакция с металлом. В ходе такой реакции в присутствии водорода иногда титан покрывается защитным слоем его гидрида. Однако в сильно концентрированной кислоте и при 100 °С эта пленка уже не защищает металл, разрушается сама и далее титан реагирует с кислотой. Хотя повреждения металла и наблюдается, но скорость коррозии титана при контакте с хлористоводородной кислотой намного ниже, чем у нержавеющих сталей. Азотная кислота HNO3, не взаимодействует с титаном и его сплавами. Дымящаяся (высококонцентрированная 30 % и более) азотная кислота сильно насыщена парами свободного оксида азота(IV) - NO2, который предает ей красно-бурый цвет. Оксид азота(IV) является очень сильным окислителем, и за счет этого реакция титана с такой кислотой протекает бурно и со взрывом. Разбавленная серная кислота H2SO4 (до 5 %) не действует на титановые материалы и изделия даже при температуре от 50 до 95 °С. Кислота более высокой концентрации (10 - 20 %) также не растворяет титан при нормальных условиях. Однако при нагревании она уже повреждает пленку оксида титана и повышает активность металла по отношению к ней.
Скорость разрушений в каждой из перечисленных кислот понижается при добавлении в них азотной, серной, соляной, хромовой кислот, соединений хлора и других пассивирующих окислителей. Этим объясняется отсутствие реакции титана с царской водкой (HNO3 + 3HCl), как с холодной, так и горячей. Он взаимодействует с ней лишь в кипящем виде или в мелкораздробленном состоянии. Органические кислоты (уксусная, винная, молочная и др.) практически не реагирует с титановыми материалами и изделиями из них.
Одной из кислот, которую титан боится «как огня», является фтористоводородная (HF) - плавиковая любой концентрации. В ее разбавленных растворах он растворяется очень быстро, а в достаточно концентрированной растворение металла подобно таянию льда на солнце и в горячей воде. Титан также подвергается разрушению в кремнефтористоводородной и ортофосфорной кислотах H3PO4 даже в очень слабых растворах. Титановые материалы и изделия корродируют под действием хлора и брома, различных спиртов, а также спиртового раствора йода, расплавленного цинка. Расплавы хлоридов металлов взаимодействуют с титаном очень быстро при температуре более 375 °С. В тоже время к расплавам многих металлов титан и его сплавы достаточно стабильны. Сюда относятся олово Sn, ртуть Hg, магний Mg, галлий Ga, литий Li, натрий Na и калий K. Однако при повышении температуры выше 300 – 400 °С расплавы этих металлов вызывают их незначительную коррозию. Из неметаллов титан не взаимодействует лишь с серой даже с расплавленной. Титан устойчив против кавитационной коррозии и коррозии под напряжением, а также в электролитах.
Титановые сплавы также обладают высокой коррозионной стойкостью в таких средах как влажная атмосфера, различная вода, концентрированная азотная кислота, растворы хлоридов, особенно NaCl, при циклических нагрузках. Высококоррозионностойкими являются сплавы титана с молибденом Мо (20 – 30 %), танталом Та, ниобием Nb, цирконием Zr, гафнием Hf и вольфрамом W (до 10 %). Благородные металлы платиновой группы платина Pt, палладий Pd, рутений Ru и родий Rh при концентрации 0,2 % уменьшают растворение титана в кипящих концентрированных соляной и серной кислотах в 10 раз.
Сплавы титана с такими металлами, как хром Cr, никель Ni и марганец Mn относятся также к коррозионностойким, но она более низкая, чем у самого металла. Алюминий и олово также незначительно снижают их коррозионную стабильность. Алюминий понижает антикоррозионные свойства по отношению к электрохимической коррозии. Сплавы на основе карбида титана обладают высокой стойкостью против таких кислот, как соляная, серная, ортофосфорная, щавелевая (холодные и горячие) хлорная HClO4 (холодная), а также в смесях этих и других кислот.
Коррозия никеля и его сплавов. Гомоядерное соединение никель – это блестящий белый металл с серебристым оттенком. В нормальных условиях никель покрыт тонким плотным слоем оксида NiO, который является защитным. Поэтому никель практически химически инертен. Он достаточно устойчив в воздушной атмосфере, пресной и морской воде. В пароводяной среде он стабилен до 450 °С. С кислородом он взаимодействует лишь при нагревании до 500 °С и выше. Образующийся оксид никеля снижает свариваемость металла. В измельченном виде и при высокой температуре (выше 400 °С) никель окисляется галогенами, серой, азотом, селеном, фосфором, мышьяком и сурьмой, а также сернистым газом SO2 и аммиаком NH3. При взаимодействии с серой формирующийся на границах зерен металла сульфид приводит к охрупчиванию никеля. По отношению к кислотам он более стоек, чем железо и кобальт. Растворы щелочей на него практически не действуют.
Сплавы никеля обладают значительной коррозионной стойкостью. Наибольшие антикоррозионные свойства имеют никелевые системы с молибденом и хромом. Они превосходят в этом даже коррозионностойкие стали. Сплавы никель-молибден не корродируют в таких кислотах как соляная, серная и ортофосфорная, никель-хром и в азотной, а также смеси ее с плавиковой. Тройные системы никель-молибден-хром более стойки в окислительных средах. Недостатком никельмолибденовых сплавов является склонность к межкристаллитной коррозии и ножевой коррозии в сварных соединениях. Однако в серосодержащей атмосфере, а особенно при нагревании, все сплавы никеля не достаточно стабильны. Никелевомедные системы имеют высокую коррозионную стойкость в воде, растворах щелочей, кислотах, не обладающих окислительными свойствами, в частности, в соляной HCl и плавиковой HF, и на воздухе. Из них широко распространенным является сплав, называемый монель-металлом. Он представляет собой однофазную систему. Данный сплав устойчив в любых агрессивных средах, за исключением азотнокислых растворов и хлорида железа. Концентрация никеля в нем до 60 - 65 %, а меди - 25 - 30 %. Нихромы и ферронихромы антикоррозионны к газовой коррозии в атмосфере воздуха до 1250 °С и в некоторых окислительных средах. Никелевые сплавы хорошо выдерживают высокие температуры и относятся к жаропрочным (850 – 1050 °С) и жаростойким до 1250 °С материалам.
Коррозия цинка и его сплавов. Гомоядерное соединение цинк является металлом синевато-белой окраски. Во влажном воздухе покрывается слоем оксида ZnO и теряет блеск. Цинк является химически активным металлом. Однако не во всех агрессивных средах это проявляется одинаково. Вода практически не оказывает разрушающего действия на цинк. Это объясняется тем, что сформировавшийся в первый момент гидроксид Zn(OH)2 нерастворим в воде, и замедляет течение реакции. Это относится в основном к жесткой технической воде, содержащей растворенные соли. Чистая (дистиллированная, мягкая) вода, лишенная солей, оказывает разрушающее действие. В данном случае чаще всего реализуется точечная коррозия.
Цинковые металлические материалы хорошо растворяются в разбавленных и концентрированных кислотах, а именно в хлористоводородной HCl, серной H2SO4 и др. В разбавленных кислотах, кроме азотной, взаимодействие протекает с бурным выделением водорода и формированием соответствующих соединений цинка. Концентрированные кислоты ведут себя по-иному. В них водород не выделяется. В серной кислоте наряду с образованием сульфата цинка происходит формирование сернистого газа SO2 и воды. Азотная кислота HNO3 в зависимости от концентрации ведет себя совершенно индивидуально. Концентрированная кислота восстанавливается при взаимодействии с цинком до оксида азота(IV) NO2, а разбавленная - оксида азота(II) NO. В обоих случаях одновременно происходит образование нитрата цинка Zn(NO3)2 и воды. Цинк и его сплавы хорошо растворяются в щелочах с формированием белого гидрооксида Zn(OH)2, обладающего амфотерными свойствами, а именно растворяющегося как в кислотах, так и в щелочах. При нагревании цинка до температуры кипения на воздухе металл воспламеняется и сгорает зеленовато-белым пламенем с трансформацией в оксид белого цвета, также относящегося к амфотерным. При высоких температурах цинковые материалы энергично реагируют с активными неметаллами, в частности, галогенами, водородом, азотом, серой, углем и др. с образованием соответствующих соединений цинка. Цинк также легко образует сплавы с большим числом металлов.
Коррозионная стабильность цинка также сильно зависит от степени чистоты металла. Технический цинк (99,9 % и 99,99 % Zn) довольно хорошо реагирует с кислотами, а вот химически чистый металл (99,999% Zn и более) устойчив по отношению к этим кислотам даже при высоких температурах.
Во влажной воздушной атмосфере, содержащей оксид углерода(IV) СО2 (углекислый газ), цинк постепенно растворяется с образованием в конечном итоге основного карбоната Zn(OH)2·2ZnCO3, который защищает металл от дальнейшего разрушения. Формирующийся продукт ложится тонким слоем на поверхность металла. Эта пленка непроницаема для многих агрессивных сред, в частности, воды. Она характеризуется высоким сцеплением с основой. На скорость коррозии цинка, а именно разрушения защитных пленок достаточное влияние оказывает значение водородного показателя среды (рН). При рН меньше 6 и больше 12 повреждения металлических цинковых материалов и изделий развивается очень быстро. В интервале рН от 6 до 12 коррозия осуществляется более медленно. В воздушной атмосфере, в которой наблюдается присутствие различных соединений серы, основной карбонат и оксид цинка переходят в растворимые сульфит ZnSO3 и сульфат ZnSO4 цинка. Данные соединения вследствие своей хорошей растворимости и плохой фиксации с основой быстро уносятся атмосферной влагой, и поверхность металла остается незащищенной и он корродирует. В морской воде скорость коррозии и состав продуктов определяется типом растворенных солей. Но в тоже время скорость повреждения замедляется из-за наличия в морской атмосфере солей магния, которые оказывают пассивирующее действие на поверхность цинка. Поэтому в общем виде разрушения металла происходит намного медленнее, чем в сельской или городской атмосфере. Однако в сельской атмосфере цинк корродирует в двадцать раз медленнее, чем углеродистая сталь. В присутствии хлора и его соединений цинковые металлические материалы подвергаются коррозии. Однако их повреждение протекает с меньшей скоростью, чем коррозия сталей в этих же условиях. Цинк и его сплавы склонны к электрохимической коррозии.
Коррозия кадмия и его сплавов. Гомоядерное соединение кадмий это серебристо-белый металл. На его поверхности во влажном воздухе образуется пленка оксида CdO белого цвета, придающая металлу матовый оттенок. При нагревании кадмий реагирует со всеми неорганическими газами и неметаллическими соединениями, в частности, серой, углеродом, фосфором, азотом, водородом, галогенами, углекислым СО2, серным SO3 и сернистым SO2, сероводородом H2S. При этом металл восстанавливается с формированием соответствующих соединений. С кислотами кадмий, как электронный аналог цинка, взаимодействует менее энергично. В ходе реакций происходит образование подобных продуктов. Кадмий в щелочах практически не растворяется. Кадмиевые металлические материалы обладают коррозионной стойкостью в пресной и морской воде, в сельской атмосфере они более стабильны, нежели в городской и промышленной.
Коррозия магния и его сплавов. Магний слабокоррозионностойкий металл. На устойчивость к разрушениям влияет чистота металла. Чем чище магний, тем он более стоек против коррозии. Коррозионная стойкость магния уменьшается в присутствии меди, хрома, свинца, кобальта, железа и никеля. Так, например, в промышленно выпускаемом магнии предельно допустимая концентрация никеля равна всего лишь 0,0005 %, а железа составляет 0,01 %. Коррозионную стойкость магния увеличивает наличие в его составе цинка, титана, циркония и марганца. Металл достаточно устойчив в сухом атмосферном воздухе, но быстро корродирует во влажном и загрязненном воздухе, в особенности сернистым газом. Магний покрыт пленкой оксида, из-за которого имеет матовый цвет. Однако эта пленка очень пористая и ее защитные свойства от коррозии незначительны. Компактные магниевые материалы при комнатной температуре являются устойчивыми к коррозии на воздухе. Другими средами, не разрушающими магний, являются сернокислый алюминий, сероуглерод, растворы едких щелочей, фтористоводородная кислота любой концентрации HF (плавиковая), водные растворы фтористых солей, аммиак NH3 и его водные растворы, ортофосфорная кислота H3PO4, концентрированная серная кислота H2SO4, углекислая щелочь, сухие углеводороды, органические галогенпроизводные, не содержащие спирта и воду, жиры и масла без кислот, ароматические соединения, этиловый и уксусный эфиры, неразбавленный C2H5OH и минеральные масла. Стойкость в неорганических соединениях фтора и ортофосфорной кислоте H3PO4 обусловлена образованием в первоначальный момент реакций тончайшего слоя фторида магния MgF2, представляющего собой прочную сплошную пленку, и малораcтворимого фосфата магния Mg3(PO4)2. Магний устойчив и по отношению к другим галогенам. При этом он не взаимодействует с сухим хлором, но очень быстро корродирует во влажном. Магний также стоек по отношению к бензину, керосину, смазочным маслам и жирам и т. п. Дистиллированная вода на металл не действует, он также достаточно устойчив к пресной холодной воде, но корродирует в горячей и морской воде. Магний разрушается под действием водных растворов следующих кислот: хлороводородной HCl, серной H2SO4, азотной HNO3 и кремнефтористоводородной. Он также подвергается коррозии в водных растворах галоидных солей, сернистых соединений, во всех оксидах азота, растворах карбоната натрия и солей аммония. На магний разрушающе действуют еще и органические кислоты, водные и спиртовые растворы хлорметила и хлорэтила, метиловый спирт, гликоли и гликолевые смеси и многие альдегиды.
Магниевые сплавы имеют низкую коррозионную стойкость во влажной атмосфере и высокую химическую активность по отношению к кислороду. Поверхность магниевых сплавов защищают от коррозии нанесением слоев лака, пленкой более стойкого металла, либо электрохимической и химической обработкой, а иногда – нанесением слоев эмали.
Коррозия олова.Олово является стойким металлом в нормальной атмосферной среде. Скорость его разрушений в различных условиях в сутки составляет: закрытом помещении - 0,0004 г/м2, сельской местности на открытом воздухе - 0,0007 г/м2, городской в промышленных районах - 0,0067 г/м2 и морской - 0,011 г/м2. Чистый металл с концентрацией олова Sn 99,99% более стоек к коррозии, однако его b-модификация, называемая белым оловом, при минус 40 °С превращается в серое (a-модификация) со скоростью 0,028 - 0,097 мм/сутки, а при 0 °С - 0,02 мм/сутки. Добавки некоторых металлов, а именно висмута и сурьмы, и в меньшей степени свинца и кадмия, замедляют скорость данного превращения. Например, введение 0,5 % висмута Bi полностью предотвращает «оловянную чуму». Олово при комнатной температуре сильно корродирует в среде, насыщенной газообразными хлором, бромом и иодом, при 100 °С и выше металл разрушается во фторе. Дистиллированная и мягкая пресная вода на олово не действует. При комнатной температуре жесткая водопроводная вода с рН равным 7,4 и 8,6 уже вызывает коррозию. Однако скорость разрушений при этом мала и в сутки составляет 0,001 и 0,0045 г/м2 соответственно. Кислоты вызывают сильную коррозию олова. Медленнее всех металл разрушается в плавиковой и цианистоводородной кислотах. Высокая скорость коррозии олова отмечается в минеральных и галогеноводородных кислотах. Под действием слабых органических кислот (концентрации ~0,75 %): янтарной, уксусной, яблочной, лимонной и малоновой олово при комнатной температуре в сутки корродирует со скоростью 0,05 - 0,1 г/м2. В присутствии кислорода и аэрации скорость коррозии повышается. Молочная и масляная кислоты (концентрации ~ 1 %) при комнатной температуре действуют на олово медленно. Во всех случаях разрушения развиваются еще быстрее при повышенной температуре и в присутствии кислорода. При высоких температурах металл сильно корродирует под действием олеиновой, стеариновой и особенно щавелевой кислот. Олово быстро разрушается под действием различных растворов сильных щелочей. Разбавленные растворы щелочей и аммиака вызывают незначительную коррозию олова. При комнатной температуре скорость коррозии олова во фруктовых соках (виноградный, томатный, лимонный, яблочный) в сутки составляет всего лишь 0,1 - 2,5 г/м2. С повышением температуры до кипения соков скорость их разрушительного воздействия увеличивается более, чем в 10 раз. Этиловый спирт при комнатной температуре вызывает медленную коррозию в сутки со скоростью 0,011 - 0,013 г/м2. На олово практически не действуют бензин, керосин и смазочные масла.
Коррозия свинца.Чистый свинец в нормальных атмосферных условиях является коррозионностойким металлическим материалом. Наличие примесей в металле изменяют его механические и физико-химические свойства. Так висмут и цинк понижают кислотоупорность, натрий, кальций и магний резко повышают твердость и прочность, но снижают стойкость свинца. Кадмий, теллур и олово увеличивают твердость и сопротивление усталости, медь и сурьма улучшают устойчивость против действия серной кислоты, медь повышает предел ползучести, а сурьма, барий и литий твердость свинца. Металл устойчив также в сухой и влажной атмосфере и средах, содержащих угольный ангидрид, сернистый газ, сероводород и серную кислоту. Свинец разрушается в городской промышленной атмосфере со скоростью 0,00043 - 0,00068 мм/год, сельской примерно 0,00023 - 0,00048 мм/год и морской около 0,00041 - 0,00056 мм/год. Из газообразных веществ при низких температурах металл не боится хлора, брома, сероводорода, оксидов серы(IV и VI) SO2 и SO3 как в сухом, так и влажном состоянии. Фтористый водород вызывает быструю коррозию свинца. Дистиллированная и пресная вода на металл не действуют. При наличии в пресной воде газообразных кислорода и диоксида углерода свинец заметно разрушается. В мягкой питьевой воде металл хорошо растворяется. Рудничные и морская воды оказывают слабое действие на свинец, скорость коррозии составляет 0,01 - 0,015 мм/год. Металл высоко устойчив в растворах сернокислых солей, а вот соли щелочных металлов и азотной кислоты сильно увеличивают скорость разрушений свинца. Разбавленная азотная кислота (концентрация меньше 70 %) вызывает у свинца быструю коррозию. Соляная кислота также влияет на металл, приводя к разрушением, однако серная кислота в обычных условиях на свинец не действует. Скорость разрушений металла в серной кислоте повышается с ростом ее концентрации (выше 90 %), а также с увеличением температуры. На свинец при комнатной температуре не действуют сернистая, фосфорная, плавиковая, хромовая и концентрированная уксусная кислоты. Но разбавленные уксусная и муравьиная кислоты в присутствии кислорода вызывают быструю коррозию свинца. В отсутствии кислорода металл достаточно стоек в органических кислотах: щавелевой, винной и жирных. В растворах сильных щелочей свинец разрушается медленно. Коррозия свинца в контакте с железом или медью в кислых растворах не увеличивается, так как свинец в этих условиях является катодом. В щелочных растворах, наоборот, при контакте с указанными металлами скорость коррозии свинца возрастает.
Коррозия хрома.Хром представляет собой металл серебристо-стального цвета с голубоватым оттенком. Он совершенно не теряет блеск при длительном нахождении в атмосферных условия, а также и при повышенных температурах (450 - 500°C). Органические кислоты на хром не действуют. Он стоек против действия серы и ее соединений, а также азотной кислоты. Разбавленные соляная и горячая серная кислоты интенсивно растворяют хром. Металл имеет высокую жаростойкость в любых атмосферных условиях.
Хром обладает высокой склонностью к пассивации в различных агрессивных средах. Она намного выше, чем у железа. Явление пассивации металла заключается в формировании на его поверхности слоя оксида, а именно Сr2О3. Хром также устойчив к питтинговой коррозии.
Хотя по сравнению с железом хром имеет более электроотрицательный электродный потенциал, он не защищает железо от коррозии. Это связано с высокой склонностью к пассивации. Окисная пленка, формирующаяся на поверхности хрома, смещает потенциал металла в положительную сторону. В образующейся гальванической паре железо - хром последний становится катодом. Хромовые покрытия обладают высочайшей отражательной способностью. Однако хромовые покрытия являются высокопористыми, а также обладают большими внутренними напряжениями. Электролитические хромовые покрытия имеют высокие твердость, жаростойкость, химическую стойкость и износоустойчивость. Из-за своей пористости тонкие электролитические блестящие хромовые покрытия практически незащищают стальные детали от разрушений. В связи с этим хром наносят вместе с медными и никелевыми покрытиями. Хромовое покрытие имеет толщину от 0,5 до 1 мкм. Даже при таких размерах покрытая хромом поверхность никеля сохраняет блеск достаточно долго. Такое декоративное трехслойное блестящее покрытие используется в приборостроении и машиностроении. Его обычно наносят на наружные детали приборов и машин (ручки, кнопки, звонковые чаши, фирменные планки, арматура, замки и т. п.). Непористыми или малопористыми являются покрытия из «молочного» хрома, который осаждается из обычных электролитов, но при определенных условиях, а также хромовые покрытия из тетрахроматных электролитов. Толщины этих покрытий составляют 20 - 30 мкм и выше. Они практически полностью защищают стальные изделия от коррозии как в атмосфере, так и в различных агрессивных средах. Нанося на поверхность из «молочного» хрома электролитическое блестящее хромовое покрытие получают изделия, которые могут служить в качестве износостойких и износоупорных, применяемых в жестких эксплуатационных условиях. Покрытия из черного хрома также наносят на поверхность из «молочного» хрома. В данном случае образуется декоративная, коррозионностойкая и прочная пленка черного цвета. Чистым хромом покрывают поверхность стальных изделий лишь в следующих случаях для:
- повышения износоустойчивости измерительного инструмента (толщина слоя 15 - 50 мкм); режущего инструмента - сверл, разверток, протяжек (толщина пленки 3 - 5 мкм) трущихся деталей приборов машин и механизмов - кареток, реек, шеек осей (толщина покрова 10 - 50 мкм); поршневых колец и цилиндров двигателей - микропористое хромирование (толщина оболочки 100 - 200 мкм);
- размерного хромирования измерительных калибров (толщина пласта 2 - 20 мкм);
- предотвращения залипания и предохранения от коррозии пресс-форм для пластмасс, стекла и подобных материалов (толщина слоя 20 - 60 мкм);
- повышения жаростойкости, защиты от коррозии и предохранения от залипания пресс-форм литья под давлением.
- восстановления размеров сработавшихся деталей.
- защиты от коррозии - «молочное» хромирование (толщина пленки 20 - 50 мк);
- износостойкое и одновременно коррозионностойкое покрытие - покрытие комбинированным (двухслойным) хромом (20 мкм молочного хрома + 30 - 50 мкм блестящего хрома).
Коррозия марганца.Марганец являетсяхимически активным металлом. Однако со всеми неметаллами (кислородом, азотом, серой, углеродом, фосфором и др.) реагирует лишь при нагревании. Их взаимодействие происходит достаточно активно. Марганец легко окисляется кислородом воздуха с образованием тонкой плотной пленки оксидов, которая защищает металл от последующего разрушения. При температурах ниже 450 °С формируется оксид марганца(IV) МnО2, в интервале 450 - 800 °С образуется оксид марганца(III) Мn2О3, а выше 800 °С формируется окалина, внешний слой которой состоит из смешанного оксида Мn3О4, а внутренний слой из оксида марганца(II) МnО. Металл хорошо растворяется в различных агрессивных газах. Марганец хорошо поглощает газообразный водород. Он очень медленно реагирует с холодной водой, но в горячей воде скорость коррозии резко возрастает. Марганец быстро растворяется в соляной, серной и азотной кислотах любой концентрации. Поэтому марганец является некоррозионностойким материалом.
Коррозия бериллия.Металлический бериллий является высококоррозионностойким. На воздухе он покрывается тонкой пленкой оксида, который защищает металл от дальнейшего окисления при повышенных температурах. Полное разрушение бериллия начинается выше 800 °C, а при 1200 °C он сгорает в кислороде. При нагревании металл корродирует в атмосфере газов: при температуре выше 600 °С бериллий окисляется хлором, выше 1200 °С разрушается под действием аммиака. При такой же температуре он растворя
Дата добавления: 2015-09-21; просмотров: 16282;
