Принципы классификации и виды коррозионных процессов
Переработка и эксплуатация материалов, изделий и конструкций осуществляется в жестких условиях (высокая температура, давление и др.) при совместном действии агрессивных компонентов внешней окружающей среды (пар, вода, кислоты, газы и т. д.), а также механических нагрузок (истирание, деформация, износ и др.). В структуре материалов происходят изменения, которые могут привести к разрушению изделий и конструкций. Данные процессы и называются коррозией. Превращения, связанные только с механическими воздействиями именуются эрозией. Коррозионным превращениям наряду с металлами подвергаются камни, пластмассы, различные полимерные и керамические материалы, деревянные изделия и др. Коррозия наносит большой экономический ущерб в хозяйственном потенциале любой страны. Он составляет порядка 3 - 5 % национального дохода. В ходе протекания коррозионных процессов выходят из строя дорогостоящие машины, механизмы, разрушаются металлические и неметаллические конструкции, аппараты, приборы, что вызывает нарушение технологических циклов, вынужденные простои, затраты на ремонт и возобновление оборудования. Наиболее интенсивно подвергаются коррозии изделия и конструкции, контактирующие с агрессивными химическими средами. Однако коррозионные процессы более всего связывают с металлическими материалами и изделиями. Практиками установлено, что за год в результате коррозии около 20 % металлических материалов и изделий приходят в негодность и направляются в виде металлолома на переплавку. Большой ущерб народному хозяйству наносят безвозвратные потери металлов в виде продуктов коррозии, отходов кислотного травления и др., что составляет около 8 % от общего количества производимых металлов и сплавов.
Слово коррозия пришло к нам из латинского языка. Оно является производным от «corrodo», что означает «грызу», а более позднее «corrosio» имеет смысл «разъедание, разрушение».
Среда, в которой осуществляется разрушение, называется коррозионной или агрессивной. Химические соединения, образующиеся в процессе коррозии, именуются ее продуктами. Они формируются на поверхности материала и практически всегда имеют яркую окраску. В редких случаях они бесцветны, и тогда коррозионный процесс обнаружить достаточно сложно.
Разрушение затрагивает форму, размеры, структуру, состав и состояние поверхности материала, изделий и конструкций. Поэтому интенсивность повреждений определяется природой материала, его химсоставом, строением, различными свойствами (химическими, физическими, термическими, технологическими и т. д.). Степень разрушений также зависит от природы окружающей среды (электролит, неэлектролит, агрегатное состояние, различные фазы, свойства – степень диссоциации, способность к гидратации и дегидратации, рН среды, тепло- и электропроводность, концентрация, окислительные и восстановительные свойства, характер и свойства образующихся продуктов, наличие примесей и их активность).
Причиной коррозии служит термодинамическая неустойчивость материалов, в частности, металлов при контакте с окружающей средой. С термодинамической точки зрения при коррозии происходит переход металлов из неустойчивого (гомоядерного соединения) в более устойчивое состояние (гетероядерные вещества) - оксиды, сульфиды, карбонаты и др. Количество теплоты, затраченное в процессе производства гомоядерных соединений металлов из руд, накапливается в них в виде свободной энергии (изобарно-изотермического потенциала – G) и делает их активными, термодинамически неустойчивыми. Металл пытается вернуться в первоначальное свое состояние, в котором существовал в природе. Коррозионные процессы сопровождаются уменьшением энергии Гиббса системы. По ее знаку и величине судят о направлении и интенсивности коррозионных процессов.
Коррозионные процессы являются окислительно-восстановительными и протекают, как правило, на границе раздела фаз (контакта) твердого вещества с газом или жидкостью, т. е. взаимодействие происходит по гетерогенному механизму.
Признаками классификации коррозионных процессов являются: механизм взаимодействия материала или изделия со средой, природа окружающей агрессивной среды и условия протекания, а также тип дополнительных воздействий, которым подвергается материал одновременно с действием коррозионной среды; вид и характер разрушений, включая объем разрушенного материала или конструкции (рис. 1.90).

Рис. 1.90 - Схема классификации процессов разрушения материалов, включая: биоповреждения, коррозию металлов и старение полимеров и керамики
По механизму взаимодействия металла со средой различают химическую и электрохимическую коррозию.
По природе окружающей агрессивной среды и условиям протеканиякоррозия подразделяется на: газовую, жидкостную, радиационную, внешним и блуждающим токами, под механическим напряжением и биологическую.
По виду и характеру разрушения коррозию делят на: сплошную, структурно-избирательную, местную, подповерхностную, щелевую и межкристаллитную.
По типу дополнительных воздействий с одновременным влиянием коррозионной среды возможны: коррозионное растрескивание или транскристаллитное разрушение, коррозия под напряжением, при трении (фреттинг) и кавитационная.
Химическая коррозия – это процесс разрушения (химического взаимодействия) металлических материалов и изделий при контакте с сухой окислительной окружающей средой, а именно газами или жидкостями, непроводящими электрический ток. Механизм газовой коррозии заключается в переходе гомоядерного металлического соединения в наиболее термодинамически устойчивое состояние за счет того, что компонент агрессивной среды отнимает (или отдает) валентные электроны, переводя металл в связанное состояние - соединение, образующие на поверхности его пленку. При этом процессы окисления и восстановления образующейся редокс-системы протекают в одном акте. Скорость данного вида разрушения определяется законами кинетики и описывается уравнением (1.12 – окисление металлов).
M0 - nē → Mn+ (ΔG < 0) (1.12)
В процессе коррозии под воздействием неэлектролитических жидкостей происходит химическое растворение металлов в них, а также в присутствующих примесях. Несмотря на сложность развития коррозионных процессов, они представляют собой обычные гетерогенные химические реакции (1.13 - 1.15.), где R – органический радикал.
2RCOOH + 2M → 2RCOOM + H2 (1.13)
2R-Cl + M → MCl2 + R – R (1.14)
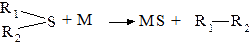 (1.15)
(1.15)
По стехиометрии уравнения реакций, описывающие химическую коррозию металлов, довольно просты, однако по механизму превращений они относятся к сложным гетерогенным процессам, и протекают в несколько стадий: диффузия исходных реагентов (газов или жидкостей) к поверхности раздела фаз; адсорбция газов или жидкостей на металлической поверхности; химическая реакция в адсорбционном слое; десорбция и удаление в объем некоторых продуктов реакция (чаще всего эта стадия во время коррозии отсутствует). Механизм коррозии определяется, прежде всего, типом агрессивной среды. Скорость развития повреждений зависит от природы металла или сплава, характера поверхности металла (дефектность, чистота обработки поверхности и т. п.), наличия примесей разной природы, температуры, природы газа, т. е. его агрессивности, давления (концентрации), свойств продуктов коррозии.
Разрушение металлических поверхностей по электрохимическому механизму является наиболее распространенным типом коррозии.
Первая ее теория была выдвинута в 1830 году швейцарским ученым Де ла Ривом. Она объясняла возникновение повреждений в месте контакта двух разных металлов. Электрохимическую коррозию в начале 19 века также изучали английские ученые Гемфри Дэви и Майкл Фарадей. Раньше данный вид поражений металлов именовали гальванической коррозией. Такое название она получила в связи с тем, что разрушение металла совершается за счет формирования на его поверхности гальванических микропар.
Электрохимическая коррозия развивается при контакте металлических материалов и изделий с электропроводящей средой (водные растворы солей, кислот, щелочей, морская вода, почва с протекающими грунтовыми водами, атмосферная влага, расплавы солей и щелочей и др.). Металл не обязательно должен быть полностью погружен в жидкость. Растворы электролитов могут находиться в виде тонкой пленки на поверхности металла. Они нередко пропитывают среду (почву, бетон и др.), окружающую металл.
Разрушения происходят за счет одновременного протекания на металле двух процессов: окисления гомоядерного металлического соединения с образованием его катионов Мn+ (анодный процесс) аналогично реакции (1.12) и восстановления окислителей - компонентов среды (катодный процесс) (рис. 1.91).
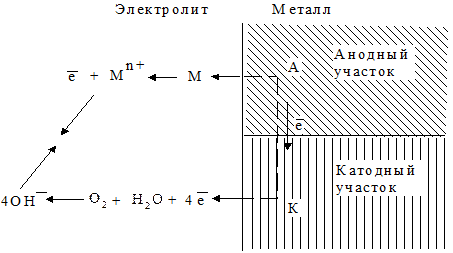
Рис. 1.91 - Схема осуществления электрохимической коррозии в растворах электролитов
В результате окисления металла осуществляется его растворение. В роли окислителей в водных растворах в кислой среде выступают ионы водорода Н+ или растворенный в воде кислород воздуха. Восстановление ионов водорода до газообразного Н2 называется водородной деполяризацией и описывается уравнением (1.16).
2Н+ + 2ē → Н2 (1.16).
Деполяризация - присоединение избыточных электронов веществами с большим химическим сродством к электронам - кислородом О2, ионами водорода Н+ и молекулами воды H2O. Так осуществляются коррозионные процессы металлов от марганца Mn до олова Sn в ряду стандартных электродных потенциалов (ряд напряжений) в кислой среде (pH < 7), металлических материалов из s-элементов I, II групп и алюминия Al в нейтральной среде (рН = 7).
Катодный процесс с участием кислорода протекает по схеме реакции (1.17).
О2 + 2Н2О + 4ē → 4OH¯ (1.17).
Он называется кислородной деполяризацией. По нему разрушаются обычно в нейтральной среде (pH = 7) металлы от марганца Mn до свинца Pb в ряду напряжений, а также малоактивные металлы подгруппы меди в кислой среде. В окислительной среде деполяризаторами могут быть анионы-окислители: CrО 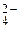 , Cr2О
, Cr2О 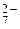 , NО
, NО 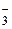 , MnО
, MnО 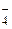 и т.д.
и т.д.
В ходе электрохимической коррозии одновременно с этими процессами наблюдается протеканиеэлектрического тока и перенос электронов от одного участка поверхности к другому, возникает разность потенциалов. Скорость разрушений зависит от электродного потенциала металла, она определяется законами электрохимической кинетики и может быть выражена в электрических единицах (например, А/м2·ч).
Данный вид коррозии вызывают загрязнения, примеси, находящиеся в металлических материалах и изделиях, различия в составе зерна металла в объеме и на границе, а также неоднородность его поверхности и различные механические напряжения.
Согласно теории электрохимической коррозии при соприкосновении металла с электролитом, в частности с водой, на его поверхности возникает множество микрогальванических элементов с различными значениями микроЭДС. При этом анодами будут частички металла, а катодами – загрязнения и примеси. Аноды растворяются, на катодах происходит связывание электронов. Совершенно чистые металлы разрушению практически не подвергаются.
На скорость коррозии влияют внутренние и внешние факторы. Внутренними причинами являются состав, структура и состояние поверхности металла и напряжения. Повышение чистоты обработки увеличивает коррозионную стойкость. К внешним факторам относятся: температура, давление, скорость движения сред, состав и свойства электролита и др. Они способны изменять электродный потенциал металла и его термодинамическую устойчивость. Скорость разрушений возрастает с уменьшением термодинамической устойчивости металла в среде электролита, т. е. с увеличением возникающей при этом ЭДС микрогальванических элементов. Процесс электрохимической коррозии сопровождается поляризацией, т. е. ростом потенциала анодных участков поверхности, и понижением потенциалов катодных областей. Это приводит к падению микроЭДС зон металла, к снижению скорости процесса. Если на поверхности металлических изделий во время коррозии образуются прочные защитные пленки, происходит пассивация анодных участков и уменьшение скорости разрушения металлов. К металлам, которые пассивируются в атмосферных условиях, относятся алюминий Al, титан Ti, хром Cr, кадмий Cd и магний Mg. Скорость повреждений также зависит от характера раствора электролита, т. е. его кислотности (рН – водородный показатель среды). Чем он ниже (лежит в интервале 7 - 0), тем выше концентрация окислителей в растворе и тем быстрее протекает коррозия. Ускорение процесса разрушения отмечается с повышением температуры.
Электрохимическая коррозия протекает в местах:
- контакта двух разных металлов;
- соприкосновения металла с продуктом коррозии;
- разной концентрации окислителя на поверхности металла;
- механических напряжений, где происходит изменение потенциала металлов.
При контакте в конструкции металлических изделий из разных металлов разрушается тот из них, потенциал которого меньше (контактная коррозия). Этот металл является анодом. Катодом служит металл с более электроположительным потенциалом. По отдельности, например, алюминий и титан устойчивы к действию морской воды, но если они контактируют в одном изделии, например в боксе для подводной фототехники, алюминий очень быстро корродирует, и бокс разрушается.
По данному механизму чаще всего коррозия металлов протекает в растворах электролитов, в атмосфере и почве с образованием равномерной и избирательной коррозии.
Продукты разрушений всегда имеют более положительный электродный потенциал, поэтому они являются катодами, а металл становится анодом и в процессе их взаимодействия очень быстро корродирует.
На поверхности металла всегда имеются участки, на которых концентрация окислителя бывает различной. Места с их высокой концентрацией становятся явной причиной точечной и питтинговой коррозии. Эти виды повреждений чаще всего отмечаются при наличии на поверхности металла отдельных капелек электролитов, т.е. при плохой смачиваемости жидким электролитом поверхности металла.
При наложении нагрузки на металл она действует на его поверхность практически всегда неравномерно. Это вызывает разницу потенциалов между напряженной и ненапряженной областями и тем самым создается условие для протекания в этих местах интенсивной транскристаллитной коррозии.
Коррозия металлов в электропроводящих растворах кислот, зависит от природы обоих компонентов, концентрации растворов, примесей, температуры и других факторов. Например, в серной и азотной кислотах с повышением их концентраций скорость растворения углеродистых и низколегированных сталей увеличивается, достигая максимума, затем резко снижается. Уменьшение коррозии с ростом концентрации раствора обусловлено образованием на поверхности металла плотной пассивной пленки. В соляной кислоте такого явления для данных металлических материалов не наблюдается, и поэтому с повышением ее концентрации разрушения продолжают развиваться.
Пример: В раствор соляной кислоты опускают брусок материала, состоящий из железа и меди. Стандартные электродные потенциалы железа и меди соответственно равны: j 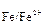 = -0,44 В; j
= -0,44 В; j 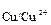 = +0,34 В. Поэтому железо как электроотрицательный элемент является более активным металлом и становится анодом. В процессе коррозии оно окисляется, посылает катионы железа(II) в раствор, где они взаимодействуют с анионами хлора с образованием хлорида железа(II) (уравнение 1.18 и 1.19).
= +0,34 В. Поэтому железо как электроотрицательный элемент является более активным металлом и становится анодом. В процессе коррозии оно окисляется, посылает катионы железа(II) в раствор, где они взаимодействуют с анионами хлора с образованием хлорида железа(II) (уравнение 1.18 и 1.19).
Fe0 - 2ē → Fe2+ (1.18)
Fe2+ + Cl¯ → FeCl2 (1.19)
Избыток электронов с железа перетекает на медь, она становится катодом. Ионы водорода, образующиеся в результате диссоциации хлорида водорода, движутся к меди, принимая от нее электроны, разряжаются до молекулярного водорода (уравнение 1.16). Этот процесс вызывает дальнейшее окисление железа до полного его связывания в хлорид Fe(II). Под действием влаги он гидролизуется с образованием гидроксида железа(II) (уравнение 1.20), который контактируя с кислородом воздуха и водой, окисляется до гидроксида железа(III) по реакции (1.21). Последний в сухой атмосфере быстро отдает воду (уравнение 1.22).
FeCl2 + Н2О → Fe(OH)2 + 2HCl (1.20).
4Fe(OH)2 + 2Н2О + O2 → 4Fe(OH)3 (1.21).
Fe(OH)3 → FeOOH + H2O (1.22).
Наиболее подвержены электрохимической коррозии металлические сплавы. В них анодными участками являются металлические компоненты с самыми низкими электродными потенциалами (наиболее активные), а катодными - инертные элементы сплавов. Латуни это сплавы меди с цинком. Следовательно, коррозия латуни может быть отображена как процесс разрушения цинка, потому что он является самым активным компонентом сплава. Использование медных или латунных деталей в железных либо алюминиевых конструкциях, которые работают в морской воде, существенно усиливает коррозию. Известны случаи разрушения и затопления кораблей, железная обшивка которых была скреплена медными заклепками.
Из вышеперечисленных типов коррозионных процессов по электрохимическому механизму протекают атмосферная коррозия, из жидкостной та, которая происходит в токопроводящих жидкостях, почвенная (подземная) и морская. При большом разнообразии природных вод от чистых деминерализованных источников, речной и морской воды до подземных вод из геотермальных скважин с содержанием солей до 100 г/л и с температурой до 200 – 250 °С коррозия металлов в большинстве случаев осуществляется по электрохимическому виду с катодным процессом восстановления кислорода. К данным разрушениям также относятся повреждения внешним и блуждающими токами.
По электрохимическому механизму также протекает стояночная коррозия. Это разрушения металлов в воде, насыщенной кислородом, происходящее при комнатной температуре после остановки оборудования ТЭЦ. Характерные особенности стояночной коррозии - образование язв на поверхности металла и накопление большого количества продуктов разрушения. После останова котла на трубах остаются мокрый шлак и зола, в которых интенсивно развивается коррозия.
Газовая коррозия осуществляется при контакте металлических материалов с сухими атмосферными и промышленными газами (кислород O2, галогены Hal2, озон O3, водород H2, азот N2, двуокись углерода СО2, водяные пары Н2О, сернистый SO2 и другие) при обычной или повышенной температуре (высокотемпературная коррозия). Большое влияние оказывает присутствие примесей и состав газовой среды. Даже при нормальных условиях скорость разрушения металлов в обычной (промышленной) или морской атмосфере различна. При наличии водяных паров усиливается разрушение всех металлов и увеличивается действие примесей других газов, например, сернистых. Дымовые газы, содержащие диоксид углерода СО2, сернистые и другие соединения инициируют и активизируют коррозию не только простых, но и нержавеющих сталей.
Газовая коррозия регистрируется в основном при эксплуатации металлического оборудования, в частности, химической обработке металлов, горячей прокатке, ковке, двигателей внутреннего сгорания и ракетных двигателей, энергетических установок лопатки газовых турбин, сопла реактивных двигателей, патрубки выхлопных газов вертолетов.
Продукты разрушений на поверхности металла образуют пленки, которые в некоторых случаях препятствуют переносу газов вглубь металлов. При этом повреждение замедляется или прекращается полностью, т. е. скорость процесса лимитируется диффузией газов. Процесс облегчается при высоких температурах. В ходе коррозии пленка продукта непрерывно утолщается. Она уже не защищает металл от дальнейшего окисления, так как содержит большие трещины и поры, в которые проникает кислород, и металл разрушается.
Таким образом, образующаяся пленка продуктов обладает защитными свойствами только тогда, когда она тонкая, сплошная, беспористая, имеет хорошее сцепление с металлом, ее коэффициент термического расширения, близок к данному параметру металла, твердая и износостойкая. Скорость газовой коррозии зависит от природы металлического материала, характера газовой среды и температуры.
Наиболее распространенной разновидностью газовой коррозии является разрушение металлических материалов при контакте с кислородом, в процессе которой происходит образование на поверхности металлов пленок из соответствующих оксидов. Особенно подвержены этому металлы, расположенные в ряду напряжений левее (после) водорода. Оксиды таких металлов, как алюминий, цинк, хром, в некоторых случаях железа, обладают защитными свойствами.
Сернистые газы очень агрессивны как для сталей, так и для цветных металлов. Однако стали корродируют в них лишь при одновременном присутствии влаги. Медь и никель разрушаются в сернистых газах независимо от наличия паров воды. Меньше всего SO2 и SO3 действуют на хром.
Сероводород H2S образует с металлами сульфиды. В большинстве случаев пленки сформировавшихся сульфидов на поверхности металлов не обладают защитным действием. Иногда образовавшиеся сульфидные пленки могут стимулировать коррозию, например сульфид железа(II) FeS. Однако, сульфид хрома(III) Сг2S3 обладает необходимыми защитными свойствами. Самым стойким по отношению к сухому сероводороду является алюминий. В среде H2S он может эксплуатироваться, не разрушаясь до 500 °С. Коррозия никеля в сероводороде начинается около 300 °С. Для меди сероводород наиболее опасен, а в присутствии кислорода воздуха он действует на металл уже при обычной температуре.
Хлор и хлористый водород - наиболее агрессивные газы. Их окислительная способность еще более увеличивается в водной среде. Большинство металлов при контакте с сухими газами начинают корродировать при 200 - 300 °С. Металлы по интенсивности повреждений располагаются в следующем порядке: алюминий, чугун, углеродистая сталь, медь и свинец. Хромоникелевая сталь типа Х18Н10Т разрушается при 400 – 450 °С, а никель - выше 540°С. Образующиеся хлориды металлов, вследствие высокого давления их паров летучи, разлагаются и не защищают поверхность металла. Летучесть хлорида никеля, по сравнению с подобными соединениями других металлов, значительно меньше, и этим объясняется высочайшая коррозионная стойкость никеля в этих газах.
В сухом хлоре титан сгорает с образованием хлоридов. Однако в присутствии воды (0,013 %) стойкость металла увеличивается.
Фтор является более активным, чем хлор. Его окислительные свойства повышаются с увеличением температуры. Наибольшей коррозионной стойкостью в нем обладают никель, алюминий, магний, железо, медь (в отсутствии кислорода) и сплав никеля с медью - монель-металл (до 400 °С). Малоуглеродистая и нержавеющая стали, а также платина имеют меньшую устойчивость (350 – 250 °С). Практически малокоррозионностойкими в данном газе являются цинк, титан, свинец и серебро (150 – 100 °С). Самые неустойчивые по отношению к фтору – хром, тантал, молибден и вольфрам. Они разрушаются под его действием уже при комнатной температуре.
Оксид углерода СО реагирует с металлами при сравнительно высоких температурах и давлении. При этом образуются летучие соединения, называемые карбонилами – М(СО)n. По наименованию продуктов реакции разрушения металлов получило название карбонильной коррозии. Она наиболее распространена для железа и его сплавов, в основном сталей.
Диоксид углерода менее опасен для металлов, чем оксид. Однако его присутствие в воздухе усиливает их процесс разрушения. По отношению к углекислому газу самыми наименее стойкими являются железо и нелегированные стали.
Воздействие водорода на металлические изделия достаточно серьезно. Его активность увеличивается при высоких температурах и давлениях. Водородная коррозия вызывает у металлов хрупкость, снижение пластичности и прочности, приводит к полному разрушению. Это явление получило название водородного охрупчивания или «водородной болезни». Оно характерно не только для железа, но и многих цветных металлов. Достаточно присущ подобный факт меди и ее сплавам.
Жидкостные коррозионные процессы - это разрушение металлов и сплавов в жидких средах: как в растворах электролитов (воды: промышленные, речные, подземные, грунтовые, морские; атмосферная влага, кислоты, щелочи, растворы солей и др.), так и в различных токонепроводящих жидкостях.
Состав промышленных вод разнообразен и зависит от вида промышленного производства материалов. Поэтому при контакте с такими водами вид и характер разрушений материалов и деталей определяется их отношением к тем или иным химическим соединениям, в том числе, воде, кислотам, щелочам и солям.
Все нелегированные и низкоуглеродистые стали корродируют в воде примерно одинаково. Важными факторами в условиях эксплуатации являются температура воды, интенсивность потока и конструкция оборудования.
При контакте металлических изделий, в частности труб, с почвенными и грунтовыми водами наблюдается почвенная (подземная, грунтовая) коррозия. Почва и грунт содержат различные химические реагенты, в том числе и влагу, обладают ионной проводимостью, и поэтому рассматриваются как своеобразные электролиты. Характерной особенностью подземной электрохимической коррозии является большое различие в скорости доставки кислорода к поверхности подземных конструкций в разных почвах (в десятки тысяч раз). Значительную роль при коррозии в почве играет образование и функционирование макрокоррозионных пар вследствие неравномерной аэрации (насыщении воздухом) отдельных участков конструкции, а также наличие в земле блуждающих токов. В ряде случаев на скорость электрохимической коррозии в подземных условиях оказывает существенное влияние также развитие биологических процессов в почве. Грунтовая коррозия зависит от пористости, влажности, электропроводности, аэрации, концентрации солей и кислотности грунта (рН лежит в пределах 3 - 9). Особенно велика коррозия в торфяных и заболоченных грунтах, в которых рН (водородный показатель) равно 3. Песчаные почвы менее агрессивны, чем глинистые. При влажности почвы около 20 % степень коррозии является наибольшей. С увеличением влажности процесс разрушений замедляется. Это связано с тем, что в сильноувлажненный грунт проникновение кислорода затрудняется и уменьшается вероятность возникновения коррозионных элементов.
Атмосферная коррозия происходит под действием агрессивных компонентов воздушной среды. Она бывает сухая, влажная и мокрая.
Сухая коррозия реализуется при полном отсутствии влаги в атмосфере (относительная влажность не более 60 %) и на поверхности металла. Она протекает по механизму химического взаимодействия металлов и неметаллов (образование защитных пленок, в том числе оксидных) и не вызывает заметных разрушений металлических изделий. В ходе ее происходит лишь потеря их декоративных свойств.
Влажная коррозия возникает при наличии в воздушной атмосфере влаги. Относительная влажность воздуха при этом лежит в пределах от 60 до 100 %. При контакте такого воздуха с металлическими изделиями или конструкциями, на поверхности металла появляется невидимый слой влаги, образующийся вследствие капиллярной, адсорбционной или ионной конденсации.
Скорость коррозии и вид разрушений металлических изделий в основном определяются величиной относительной влажности окружающей среды. Рост относительной влажности влечет за собой увеличение толщины адсорбционного слоя электролита на поверхности металла, и приводит к повышению скорости атмосферной коррозии. Существует критическая величина данного параметра, ниже которого разрушения незначительны. Для железа и сталей она лежит в интервале 63 - 65 %. Для меди, никеля и цинка эти значения находятся в точке около 70 %. Выше нее на поверхности металла возникают адсорбционные слои влаги, служащие растворителями агрессивных компонентов атмосферы.
Мокрая атмосферная коррозия происходит при прямом контакте металлических изделий с атмосферной влагой (роса, туман, дождь и снег) или влажным воздухом (относительная влажность равна 100 %). Толщина образующихся при этом пленок влаги зависит от ориентации металла относительно земли и может изменяться в широком диапазоне.
На атмосферную коррозию металлов очень сильно влияет температура окружающей среды. С повышением температуры коррозионная активность атмосферной среды резко возрастает. Это связано с увеличением интенсивности протекания электрохимических процессов, лежащих в основе разрушений. Последующий рост температуры, обычно, тормозит коррозию. Данный факт связан со снижением относительной влажности, приводящей к высыханию поверхности металла и понижающей возможность растворения газов в воде. Совместное влияние высокой влажности и температуры сильно инициирует процесс разрушения. В большинстве случаев он еще дополняется биокоррозией. Перечисленные факторы в основном свойственны тропической атмосфере.
Помимо указанных факторов скорость коррозии определяется также химическим составом атмосферы. Загрязняющие примеси (SO2, NO2, CO, NH3 и др.) растворяются в пленках влаги, образуя электролит. При этом возникают условия протекания коррозии по электрохимическому механизму. В зависимости от типа и концентрации примесей при одинаковой влажности поверхности металла скорость ее разрушений может сильно отличаться.
По химическим свойствам примеси подразделяют на нейтральные (солевые), кислотные, окислительно-восстановительные и смешанные.
В первую группу входят основные компоненты солевого состава морской воды: хлориды, сульфаты, бромиды, йодиды. Вторую группу составляют примеси атмосферы промышленных районов. К ним относятся пары сернистой, серной, соляной и других неорганических кислот. Третью группу образуют сернистый газ и окислы азота. Последняя четвертая группа наиболее разнообразна. Она включает в себя природные соединения любых агрегатных состояний. При этом специфическое место занимают твердые вещества (уголь, соль, песок и др.). Они способствуют увеличению электропроводности электролита, обеспечивают адсорбцию различных газов и влаги из воздуха, вызывают рост конденсации влаги.
По природе и количеству загрязняющих примесей атмосферу разбивают на: промышленную, городскую, сельскую, морскую, тропическую и т. д. Средняя скорость коррозии металлов в промышленной атмосфере в 10 - 20 раз меньше, чем в морской воде или почве.
На развитие процессов коррозии влияют сами продукты коррозии. В зависимости от природы металла и примесей в воздухе образующиеся продукты коррозии на поверхности металла обладают различными физико-химическими свойствами. В одних случаях они замедляют развитие коррозии (например, при формировании нерастворимых соединений титана гидроокисей), в других ускоряют (если образуются растворимые соединения). При этом существенную роль играют гигроскопичность и адсорбционная способность продуктов коррозии. Предполагают, что повышенная чувствительность продуктов коррозии к влаге и агрессивным примесям в воздухе может приводить к интенсивному течению коррозионных процессов даже в условиях, где чистая поверхность металла сохраняет пассивное состояние.
В ходе осуществления атмосферной коррозии разрушения проникают далеко внутрь металлической поверхности, что приводит к изменению объемных свойств материала.
При воздействии морской воды на металлические изделия и конструкции последние подвергаются морской коррозии. Морская вода содержит в своем составе различные химические соединения, являющиеся по отношению к металлическим материалам, окислителями, усиливающими разрушения под действием незагрязненной воды. В данном качестве чаще всего выступают галогениды, сульфаты и карбонаты s-металлов – натрия, калия, кальция и магния. Они относятся к сильным электролитам. Их высокая степень диссоциации вызывает уменьшение омического сопротивления морской воды и способствует формированию легкорастворимых продуктов коррозии. Это приводит к резкому увеличению скорости разрушения металла. Повышение температуры в данном случае способствует еще большему росту скорости коррозии.
Вещества, непроводящие электрический ток, называются неэлектролитами. К ним относятся следующие жидкие органические соединения: спирт, бензол, хлороформ, нефть и нефтепродукты - бензин, керосин, лигроин, смазочные масла и др., а также ряд жидкостей неорганического происхождения - расплавленная сера, жидкий бром и др.
В чистом виде органические жидкости в подавляющем большинстве инертны по отношению к железу и его сплавам, но некоторые из них, например галоидпроизводные углеводороды, меркаптаны и другие серосодержащие соединения, могут реагировать с цветными металлами.
При взаимодействии галоидпроизводных углеводородов с магнием, оловом и серебром образуются соли и соответствующие углеводороды, с цинком - металлоорганические соединения, с алюминием - галоидпроизводные другого типа.
Серосодержащие соединения типа R-SH (тиоспирты или меркаптаны) взаимодействуют с металлами (медь, кобальт, никель, серебро и свинец) с образованием тиоэфиров - меркаптидов.
Натрий, калий и алюминий растворяются в спиртах и карбоновых кислотах с формированием соответствующих алкоголятов или солей.
Высшие жирные кислоты, типа стеариновой С17Н35ОН в расплавленном виде взаимодействуют с металлами, в том числе и железом. В ходе протекающих реакций происходит выделение водорода и образование соответствующих солей.
Третичные амины (R3-N), такие как триэтаноламин, особенно опасны для меди и ее сплавов.
Сама нефть и нефтепродукты (бензин, керосин, лигроин, минеральные масла и др.) не разрушают металлы. В данных жидкостях коррозию вызывают присутствующие в них примеси или входящие в их состав непредельные углеводороды, способные к окислению.
Например, крекинг-бензины окисляются кислородом воздуха. В процессе окисления в них накапливаются альдегиды, кислоты, смологены и другие продукты, которые и инициируют коррозию металлов. Разрушению подвергаются в основном стальные детали двигателей, работающих на бензине. На скорость коррозии сильно влияет присутствие в бензине серосодержащих соединений. Рост повреждений металлических изделий имеет прямопропорциональную зависимость от концентрации серы.
В процессе горения топлива серосодержащие примеси разлагаются с формированием сернистого газа – SO2, который растворяется в парах воды. При этом образуется сернистая кислота – H2SO3. Она при контакте с кислородом воздуха переходит в серную кислоту - H2SO4. Последняя по отношению к металлам является сильным окислителем.
Коррозия в жидких неэлектролитах связана еще и с тем, что углеводороды в процессе эксплуатации в воздушной атмосфере окисляются до соответствующих органических кислот, которые в основном растворяют большинство металлических изделий.
Сельскохозяйственные машины подвержены разрушениям при контакте с кислыми (водные растворы хлорофоса, медного купороса), щелочными (растворы трихлорацетата натрия, бордовской жидкости) и нейтральными электролитами (плав, пропанид и др.).
Разрушения металлов и сплавов под действием облучения нейтронами или высокоэнергетическими заряженными частицами называются радиационной коррозией. Это сложный процесс, в основе которого лежат различные ядерные реакции.
Радиационные дефекты условно делят на четыре группы:
1) одиночные точечные; 2) субмикроскопические комплексы, состоящие из 3 - 10 элементарных повреждений; 3) скопления микроскопических изъянов, содержащих более 10 простых несовершенств; 4) примесные нарушения.
Простейшие точечные дефекты это нарушения строения кристаллической решетки – вакансии и межузельные атомы.
Субмикроскопические комплексы в большинстве случаев представляют собой «рыхлые» образования, не имеющие какой-либо отчетливой формы.
Скопления микроскопических изъянов состоят в основном из кластеров, дислокационных петель и вакансионных пор. Кластеры это относительно небольшие трехмерные неплотные сосредоточения простых дефектов размером ~ 10 нм, обладающие значительными полями упругих напряжений. Дислокационные петли представляют собой собрания плоских вакансий или межузельных атомов в плотноупакованных плоскостях решетки. Их величины достигают порядка 1 – 1000 нм и сохраняются в материале до сравнительно высокой температуры (около 0,6Тпл). Вакансионные поры образуются в ходе облучения металлов при температуре от 0,25 до 0,6Тпл. Максимальные дыры видны под световым микроскопом.
Под примесными нарушениями понимают искажения кристаллической решетки материала в результате наличия в нем чужеродных ядер, их взаимодействия с подобными в основной матрице и дефектами кристалла.
В процессе облучения нейтронами в сталях и сплавах в ходе протекания ядерных реакций образуются радиоактивные изотопы химических элементов. Ими являются водород, гелий, литий и другие, а в золоте – ртуть.
Радиационные повреждения большими флюенсами нейтронов приводят к изменению состава сталей и по основным легирующим добавкам. Среди формирующихся применяемых атомов особо выделяется гелий, способствующий образованию зародышей вакансионных пор или газовых пузырьков.
Множество дефектов при облучении в реакторных материалах возникает вследствие бомбардировки конструкционных материалов ядерными частицами и проявляется в растрескивании и усталости при термическом циклировании, радиационном распухании и ползучести, которые могут лимитировать стабильность аппаратуры и оборудования. Облучения, сопровождающиеся упрочнением и уменьшением пластичности материалов, называются радиационным упрочнением и охрупчиванием. Прочность облученного материала выше, а пластичность - ниже. Увеличение прочности при этом объясняется тем, что создаваемые дефекты могут быть дополнительными центрами закрепления дислокаций (рис. 1.92). Мерой мягкости служит относительная деформация. При бомбардировке деталей флюенсами быстрых нейтронов происходят типичные изменения их размеров (рис. 1.93).

Рис. 1.92 - Диаграмма растяжения стали до и после облучения
Падение пластичности – результат охрупчивания, обусловленного наличием примесей, которыми служат продукты ядерных реакций (гелий, водород, азот и др.). Радиационное упрочнение и охрупчивание связаны с основными дефектами кристаллической решетки материала: вакансиями, междоузлиями, дислокациями и атомными примесями. Обычно для нержавеющих сталей наблюдается гелиевое, а для циркониевых сталей – водородное охрупчивание.
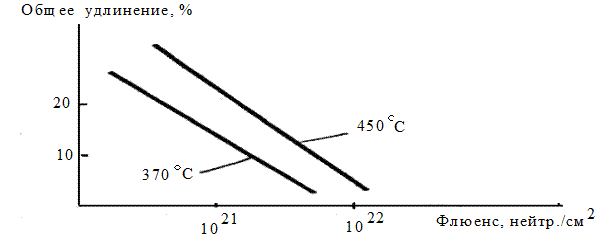
Рис. 1.93 - Зависимость удлинения нержавеющей стали от флюенса быстрых нейтронов
Нейтронное облучение может сместить температуру перехода к хрупкому разрушению из области отрицательных значений в зону рабочих величин. Особенно характерно охрупчивание для материалов корпусов ядерных реакторов.
В облучаемых металлах и сплавах иногда происходит пересыщение решетки точечными дефектами, вызывающее зарождение и развитие объемных скоплений вакансионных пор. Это приводит к общему увеличению объема кристалла, называемого распуханием.
Таким образом, радиационное распухание – объемная нестабильность структуры, вследствие формирования в ней большого числа пор и пузырей. Также оно характеризуется значительным скоплением образующихся инертных газов (криптона, ксенона и гелия) в топливных и конструкционных материалах реакторов.
К нежелательным последствиям данного явления относятся деформация, изгибы и увеличение объема деталей и аппаратов. Так, например, повышение объема до 6 % и более может вызвать «самосваривание» элементов конструкций при облучении.
Неравномерность распухания является причиной создания в оболочках реакторов сложных напряженных состояний, способствующих ускорению процессов ползучести.
Ползучесть, вызываемая облучением и сопровождающаяся высокой пластичностью материалов, называется радиационной. Для одного и того же сплава она происходит намного быстрее обычной термической ползучести.
Основную роль радиационная ползучесть играет при температурах ниже 0,45 Тпл, а при значениях около 0,5 Тпл ее вклад в деформацию становится сравним с термической компонентой. В ходе высокотемпературного облучения (выше 0,5 Тпл) превалирующей оказывается термическая составляющая, скорость которой изменяется по экспоненциальному закону (рис. 1.94).



Рис. 1.94. Сравнение кривых ползучести нержавеющей стали: 1 – радиационная; 2 – термическая
Облучение ядерных реакторов усиливает фазовые и структурные модификации их материалов, имеющие место и без него в определенных условиях эксплуатации.
В сталях и сплавах реакторостроения часто встречаются такие превращения как сегрегация (локальное пересыщение растворенным элементом за пределами растворимости), образование избыточной фазы, растворение и формоизменение выделения второй фазы, распад и формирование новых соединений.
Фазовые превращения, которые ускоряются или даже возникают в процессе облучения, условно разделяют на радиационно-ускоренные и радиационно-индуцированные.
В первую группу входят такие трансформации как ускоренный распад пересыщенных твердых растворов, упорядочение сплавов, рост зародышей второй фазы и другие.
Ко второму типу относят сегрегацию элементов, образование новой фазы, разупрочнение сплавов и тому подобное.
В аустенитных сталях типов 1Х18Н9Т, 0Х16Н15М3Б в результате облучения наблюдаются выделения ферромагнитной a-фазы, карбидов сложного состава и карбонитридов. В сплавах последней марки в ходе воздействия быстрых нейтронов при 420 – 885 °С происходит образование мелкодисперсных карбонитридов ниобия в теле зерна и относительно крупных карбидов типа М23С6 по его границам. При облучении железоуглеродистых сплавов наблюдается радиационно-индуцированное формоизменение выделений карбида железа, входящего в перлитную структуру под названием цементита. Также может регистрироваться перестройка пластинчатого цементита в зернистую структуру.
Одновременное воздействие радиационного распухания и ползучести на материал приводит к весьма нежелательным эффектам, например, к изменению формы элементов конструкций, а следовательно, и к нарушению режимов работы реакторов в процессе эксплуатации, созданию аварийных ситуаций.
Коррозия внешним током– это воздействие внешнего источника тока (анодное или катодное заземление), а разрушения блуждающими токами - прохождение тока по непредусмотренным путям по проекту. Данный вид разрушений еще называют электрической или электрокоррозией. Блуждающие токи (токи утечки), исходящие от трамваев, метро, электрических железных дорог и различных электроустановок, работающих на постоянном токе разрушают подземные металлические сооружения, трубопроводы и электрокабели. Различного рода токи утечки, проходя в грунте и встречая металлическую поверхность, проникают в нее и вызывают появление участков входа и выхода тока. Это приводит к образованию на металле катодных и анодных зон. В месте протекания и выхода тока происходит усиленное анодное растворение металла, а в районе входа - катодное подщелачивание грунта. Блуждающие токи от источников переменного тока вызывают слабую коррозию у подземных изделий из стали и сильную – из цветных металлов. Эти токи могут достигать несколько ампер, что приводит к большим коррозионным разрушениям. Так, прохождение тока силой в 1 А в течение одного года вызывает растворение 9,1 кг железа; 10,7 кг цинка; 33,4 кг свинца.
Например, при движении электротранспорта по рельсам поток электронов от источника тока попадает в воздушный провод и по рельсам возвращается назад. Часть тока уходит в грунт. На стыке рельсов в почву поступает самый мощный поток электронов, образующийся в результате возникающего резкого скачка сопротивления. Электроны, ответвляющие на участке К1, связываются молекулами кислорода, растворенного в подземных водах, или ионами водорода. В данном случае часть рельса в области К1 становится катодом. На нем осуществляются процессы восстановления: в нейтральной среде происходит подщелачивание грунта по реакции (1.17), в кислых почвах образуется водород (1.16). С поверхности рельса (участок А2 - анод) в ходе процессов окисления во влажный грунт переходят катионы железа(II), которые связываются в его гидроксид, окисляющийся в аналогичное производное железа(III). Данные реакции происходят аналогично уравнениям (7 – 10). В тот же момент в области A1 трубы, связанной с рельсом, также наблюдается процесс окисления железа в ходе которого образуются свободные электроны. Все они переходят в зону К2, где разделяются на две части. Первая (большая по величине) вливается в главный поток электронов, посылаемых генератором постоянного тока. Вторая уходит во влажную почву, а на данном участке трубы (область К2) происходит восстановление молекул кислорода или ионов водорода по уравнениям (1.16 и 1.17).
Таким образом, блуждающий ток образует своеобразную петлю, в результате которой одновременно разрушаются рельс и труба (рис. 1.95).
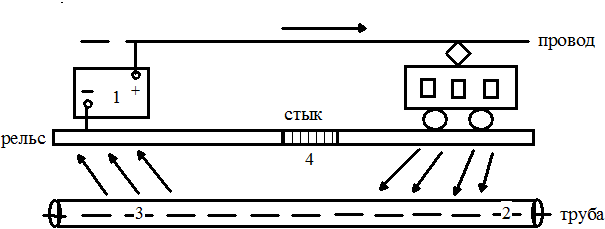
Рис. 1.95 - Распределение блуждающего тока по трубопроводу при воздействии электрифицированной железной дороги: 1 – преобразовательная подстанция; 2 – катодная зона; 3 – анодная зона; 4 – нейтральная зона
Коррозия под напряжением - это разрушения при одновременном воздействии коррозионной среды и постоянных или временных напряжений. Статические напряжения могут понижать термодинамическую устойчивость металла, разрушать защитные пленки. При неравномерном распределении механических напряжений сжатые области кристаллической решетки металлов вследствие перераспределения электронов, заряжаются положительно, а растянутые - отрицательно. Синхронное действие циклических растягивающих напряжений и коррозионной среды вызывает коррозионную усталость, т. е. происходит преждевременное разрушение металлических материалов и изделий. Этот процесс можно представить следующим образом: сначала на поверхности изделия возникает местная коррозия в виде язв, которые начинают действовать в качестве концентратора напряжений, максимальное значение напряжения будет на дне язв, которое имеет более отрицательный потенциал, чем стенки, в результате чего разрушение металла будет идти вглубь, а язва будет переходить в трещину. Данному виду коррозии подвержены валы гребных винтов, рессоры автомобилей, канаты, охлаждаемые валки прокатных станов и др.
Биологическая коррозия или биоповреждения заключается в разрушенииматериалов и изделий, вызываемом продуктами жизнедеятельности микроорганизмов или биоагентами (биофакторами). К биоагентам относятся бактерии, грибы, актиномицеты, а также насекомые, грызуны и др. Живые организмы повреждают материалы и изделия, ухудшают их технологические характеристики и свойства, затрудняют работу.Из них коррозию металлов вызывают в основном бактерии и грибы. Разрушение металла начинается на загрязненной органическими соединениями поверхности изделия. На них могут поселяться споры бактерий и плесневых грибов. Коррозия также может происходить в местах, где имеются контакты металла с неметаллом. Последние способны быть пищей для бактерий и грибов. При выделении биоагентами органических кислот и наличии влаги на поверхности металлов их разрушение усиливается.
Бактерии имеют достаточно малый размер, который составляет от 0,8 - 1,2 до 2 - 10 мкм. Отдельные виды бактерий более крупные и достигают до 20 - 50 мкм. Одни из них передвигаются с помощью жгутиков, представляющих собой тонкие длинные завивающиеся нити сложной белковой природы. Другие типы образуют споры - тельца сферической или эллиптической формы.
Спорообразование - одно из средств приспособления бактерий к неблагоприятным внешним условиям (недостатку питательных веществ, наличию вредных продуктов обмена в окружающей среде, слишком высокой или низкой температуре). В таком виде бактерии сохраняют свою жизнеспособность десятки и сотни лет в состоянии покоя. В благоприятных условиях cпора очень быстро начинает расти, превращаясь в новую вегетативную клетку, типичную для данного вида микроорганизма. Период взросления споры составляет всего лишь нескольких часов.
Клетки бактерий в процессе деления и роста на загрязненной поверхности металлического изделия образуют бактериальные колонии потомков, которые чаще всего приобретают такие размеры, что их можно видеть невооруженным глазом.
Развитие бактерий на поверхности металлических конструкций осуществляется при их контакте с почвой, грунтовыми водами и в различных водоемах. Биохимическая коррозия носит сезонный характер и наиболее интенсивна в весенний период, когда создаются наилучшие условия для развития и существования бактерий. Они могут ускорить процесс разрушения металлической поверхности в 20 раз.
К разрушителям металлов относятся водородные, нитрифицирующие, сульфатредуцирующие, сероокисляющие, аммонифицирующие, нитрофицирующие, метанообразующие бактерии, а также серо- и железобактерии.
Микробы, существующие и развивающиеся только в присутствии кислорода, называются аэробными. К ним относятся - окислители серы и железомикробы, осаждающие железо.
Первые лучше всего созревают в кислой среде. Они встречаются в твердых грунтах почвы, болотах и воде. Сущность их действия состоит в том, что они могут окислять серу до серной кислоты, местная концентрация которой может доходить до 10 %. Образующиеся серная кислота и сульфаты разрушают бетонные сооружения и вызывают усиленную коррозию металлов.
Железобактерии распространены в пресных водах, богатых восстановленными неорганическими или органическими соединениями железа. Они хорошо формируются в интервале рН от 4 до 10. В благоприятных условиях образуют колонии, покрытые коркой оксида железа, могут вызывать коррозионные разрушения водопроводных стальных труб. Они поглощают железо в ионном состоянии и выделяют его в виде нерастворимых соединений. Эти соединения неравномерно распределены по поверхности металла и имеют отличный от него электродный потенциал. Возникающая электрохимическая гетерогенность поверхности усиливает коррозию.
Наиболее опасны анаэробные сульфатредуцирующие (сульфатвосстанавливающие) бактерии, так как они развиваются даже при отсутствии кислорода при рН от 5 до 9. Они активно поглощают водород, выделяющийся при катодном процессе (водородная деполяризация) и используют его при восстановлении содержащихся в грунте сульфатов до их сульфидов с последующим образованием газообразного сероводорода (реакции 1.23 и 1.24).
SO 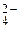 + 8H0 → S2- + 4H2O (1.23)
+ 8H0 → S2- + 4H2O (1.23)
2S2- + H+ → H2S (1.24).
Он является сильнейшим ядом для черных металлов. Присутствие в коррозионной среде сульфидов и сероводорода ускоряет коррозию. Находящиеся в растворе ионы металла, например, железа(II) связывают часть выделяющегося сероводорода. На поверхности металла образуется налет сульфида железа, который облегчает протекание реакции катодной деполяризации. Непрореагировавший сероводород окисляется до свободной серы и далее до серной кислоты (по реакциям 1.25 и 1.26), которая является сильным окислителем. Коррозия имеет питтинговый характер.
2H2S + O2 → 2H2O + 2S (1.25)
2S + 3O2 + 2H2O → 2H2SO4 (1.26).
Таким образом, они вызывают сероводородную коррозию металлов, а также коррозионное поражение (до 50% от общего ущерба) трубопроводов, особенно в заболоченных почвах. Способны разрушать нефтепродукты.
Аммонифицирующие бактерии образуют коррозионно-активные соединения (NH3, CO2, H2S) и ряд минеральных и органических кислот, которые ускоряют коррозию металлов в 2 раза и разрушительно действуют на органические материалы.
Нитрифицирующие бактерии распространены почти повсеместно. Образуют коррозионно-активные соединения - азотную и азотистые кислоты. Развиваются при рН 6,0 - 8,6. Оптимальная температура 30 – 37 °С.
Денитрифицирующие бактерии распространены в реках, почве, навозе, сточных и загрязненных водах. Интенсивно окисляют органические субстраты до СО2 и Н2СО3, способствуют протеканию коррозионных процессов металлов.
Водородоокисляющие бактерии распространены в нейтральных или слабощелочных средах. Используя водород, окисляющийся на катоде, вызывают катодную деполяризацию и способствуют этим развитию коррозии (особенно алюминия и его сплавов).
Обрастание подводной части судов мелкими морскими организмами оказывает влияние на коррозионные процессы и также относится к биокоррозии.
Грибы обширное сообщество растительных организмов, составляющих более 100 тыс. видов. Среди грибов, вызывающих биоповреждения различных материалов, изделий и сооружений, описано около трехсот видов.
Грибы можно разделить на две большие группы: макрофиты, образующие плодовые тела (в том числе съедобные грибы), и микрофиты - микроскопические грибы.
Микроскопические грибы значительно крупнее бактерий. Диаметр их гиф колеблется от 5 до 50мкм и более. Гифы могут быть одноклеточными (не имеют перс городок) и многоклеточными (имеют перегородки). Стрости клеток грибов мало чем отличается от строения других микроорганизмов. Один из отличительных признаков грибов наличие мицелия. Отдельные участки мицелия грибов могут превращаться в различные специальные образования, служащие для сохранения или для размножения вида. Мицелии обычно развивается на поверхности субстрата, часть его проникает в субстрат. В этом случае происходит специфически разрушение материала.
Мицелиальные грибы - самые активные из микроорганизмов разрушители материалов. Причем повреждающая способность отдельных видов грибов неодинаковая. Большинство видов повреждают два - три типа субстратов, некоторые виды – четыре - пять. Обнаружены грибы и с более широким спектром повреждаемости материалов - до семи - восьми типов субстратов. Наиболее сильно разрушаются материалы на органической основе (кожа, ткани, нефтепродукты, дерево и пр.). При определенных условиях не выдерживают воздействия плесневых грибов металлы и сплавы, керамика и стекло.
Воздействия этой группы микроорганизмов на материалм можно классифицировать следующим образом.
1. Химическое воздействие на материал агрессивных продуктов жизнедеятельности плесневых грибов, к которым относятся органические кислоты (щавелевая, уксусная, винная, муравьиная, малоновая, лимонная, фумаровая, яблочная и пр.), гидралазы, аминокислоты и ферменты, вызывающие расщепление, перенос, изомеризацию, окислительно-восстановительные процессы.
2Непосредственное потребление материала или его отдельныx компонентов или продуктов питания. Такое непосредственное воздействие наблюдается при развитии грибов на бумаге, текстильных изделиях, коже, шерсти, древесине.
3. Создание местной повышенной влажности и токопроводящих сред, способствующих усилению процессов коррозии материалов и изменению их свойств (например, электроизоляционных и др.).
Для биоагентов (живых организмов) характерна динамическая способность реагировать на окружающую среду. В результате непрерывной эволюции, измеряемой непродолжительными периодами времени, изменяется видовой состав микроорганизмов, а следовательно, и характер воздействия их на материал.
Сначала поселяются наиболее специфические для данного материала микроорганизмы, обладающие соответствующими ферментами и начинающие процесс разрушения, затем их сменяют группы микробов, использующие начинающий разрушаться субстрат. И, наконец, наступает очередь организмов, живущих на полностью разрушенных материалах.
В свою очередь, нестабильность состава материала и появление новых искусственных материалов ускоряют эволюцию микроорганизмов, принуждая их совершенствовать свой ферментативный аппарат и усиливать химическую агрессивность продуктов метаболизма. Это приводит к ускорение процессов микробиологических повреждений конструкционных материалов и усложняет изыскание эффективных долгодействующих средств и способов защиты.
Появление на материале тех или иных химических агрессивных продуктов жизнедеятельности микроскопических грибов зависит от того, какая конкретно микрофлора появляется на материале. Замечено, что характер микрофлоры, в свою очередь, определяется материалом, на котором она формируется, и мало зависит от климатического района. Существует и другое мнение, согласно которому видовой coстав грибов специфичен для каждой почвенно-климатической зоны и формируется из видов, составляющих характерное для почвы этой зоны сообщество грибов.
Вместе с тем в любом случае климатические условия, так же как и наличие на материале различных неорганических и органических загрязнений, в значительной степени обусловливают интенсивность развития микрофлоры и характер ее воздействия на материал.
При благоприятных условиях развития микроорганизмов биоповреждению может подвергнуться практически любой материал. Так, для металлов биологическое повреждение проявляется по существу, в различных видах коррозии; поверхностной, почвенной, атмосферной, электрохимической, под напряжением и др. Биокоррозия наблюдается при эксплуатации подземных металлических сооружений, металлических труб с проточной водой, топливных емкостей, силовых элементов строительных конструкций, авиационной техники и др. Для силовых элементов она опасна тем, что может в значительной степени стимулировать коррозию под напряжением. При этом некоторые высокопрочные сплавы, устойчивые к коррозии под напряжением, становятся абсолютно неустойчивыми под воздействием биологически активных сред, каковыми являются продукты жизнедеятельности микроорганизмов.
Грибы на металлических деталях и покрытиях развиваются за счет внешних загрязнений в процессе их изготовления, хранения, эксплуатации, за счет продуктов атмосферной коррозии, в результате контакта с деталями из неметаллических материалов, поражаемых грибами. Грибоустойчивость металлических изделий зависит также от структуры их поверхности. На поверхности металлов и покрытий, обладающих повышенной пористостью, создаются наиболее благоприятные условия для развития грибов.
Наиболее сильному разрушению с участием плесневых грибов подвержены стали, алюминиевые и магниевые сплавы, а также детали с различными металлическими покрытиями.
Сплошная коррозия регистрируется, когда ей подвергается вся поверхность материала или изделия.К данному виду относится разрушение металлов и сплавов под действием кислот, щелочей и атмосферы. Они бывают равномерные и неравномерные. При равномерном процессе разрушение металлических материалов протекает с одинаковой скоростью по всей его поверхности (рис. 1.96). Формы коррозионного поражения могут отличаться только неровностью поверхности (рис. 1.96а и 1.96б) или являться переходной между сплошной и структурно-избирательной коррозией (рис. 1.96в).
| 
| 
|
| а | б | в |
Рис. 1.96 - Виды сплошной коррозии
Если скорость коррозии на отдельных участках поверхности неодинакова, то отмечается неравномерное разрушение. Примерами равномерной коррозии являются разрушения меди под действием азотной, железа - соляной, цинка - серной кислотами, а алюминия - растворами щелочей. В этих случаях продукты коррозии не остаются на поверхности металла. Аналогично корродируют железные трубы на открытом воздухе. При удалении с металлической поверхности слоя ржавчины под ним обнаруживается шероховатый пласт, равномерно распределенный по всей трубе. Сплошная коррозия не представляет особой опасности для конструкций и аппаратов, особенно в тех случаях, когда потери металлов не превышают технически обоснованных норм. Ее последствия могут быть сравнительно легко учтены. Значительно серьезнее местная коррозия, хотя потери металла здесь могут быть и небольшими.
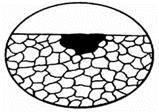
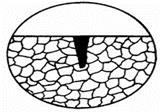
При местной коррозии на металлической поверхности поражения развиваются на отдельных небольших участках. В зависимости от характера разрушений местная коррозия бывает в виде пятен, язв и точек (рис. 1.97). Все они протекают по неметаллическим включениям сплавов.
Коррозия пятнами – это процесс разъедания практически на поверхности, малоуглубленный в толщину, но хорошо заметный. В ходе ее развития наблюдается мелкое коррозионное поражение поверхности неправильной формы. Масштаб его площади превышает размер поля зрения (рис. 1.97а).
| 
| 
|
| а | б | в |
Рис. 1.97 - Типы местной коррозии
Разрушение язвами проникает достаточно сильно в толщу металла. Его глубина приблизительно равна ширине (рис. 1.97б).
Точечная коррозия практически еле различима, но поражает металлическую поверхность очень глубоко. Ее размеры значительно больше ширины. Она заключается в образовании сквозных разрушений, т. е. в формировании полостей – так называемых питтингов (рис. 1.97в).
Местной коррозии благоприятствуют морская вода, растворы солей, в частности галогенидных (хлорид натрия, магния и др.). Особенно большие неприятности связаны с хлоридом натрия, разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. Под действием хлористого натрия последние быстро плавятся, и образующиеся ими растворы стекают в канализационные трубопроводы. Растворы хлоридов активных металлов являются активаторами коррозии и приводят к ускоренному разрушению металлов, в частности транспортных средств и подземных коммуникаций. Опасность местной коррозии состоит еще и в том, что, снижая прочность отдельных участков, она резко уменьшает надежность конструкций, сооружений, аппаратов. Коррозия в виде язв и точек также очень опасна для таких конструкций, где важно поддерживать условия герметичности и непроницаемости (емкости, аппараты, трубопроводы, применяемые в химической промышленности).
Наибольшую тяжесть представляет структурно-избирательная коррозия. Ей подвержены металлические сплавы, содержащие фазы с различными термодинамическими свойствами (рис. 1.98).
Данная коррозия з
Дата добавления: 2015-09-21; просмотров: 4978;
