Алюминий и его сплавы
Алюминий - химический элемент III группы периодической системы элементов Д. И. Менделеева. Химический знак А1, порядковый номер 13, масса 26,98. Алюминий является одним из распространенных и третьим элементом после кислорода и кремния на Земле. Из металлов по нахождению в природе ему принадлежит первое место. Общее содержание алюминия в земной коре составляет 8,8 % масс. В свободном виде в природе он не встречается, а входит в состав некоторых соединений, таких как: алюмосиликаты, бокситы, корунд, криолит и другие.
Алюмосиликаты - это вещества, главными компонентами которых являются оксиды кремния и алюминия, отвечающие общей формуле Al2O3-2SiО2-2H2O. Они входят в состав многих горных пород и глин.
Боксит - горная порода, содержащая главным образом гидроксид алюминия и окислы железа. Обычно его состав выражают формулой Al2O3·nH2O. Боксит служит рудой, из которой получают алюминий.
Корунд- минерал состава Al2O3, применяется как абразивный материал и драгоценный камень в ювелирном деле.
Криолит- минерал состава Na3[AIF6]. Его массовая доля в земной коре составляет 8,8 %. В настоящее время он получается искусственным путем.
Химический элемент Al состоит из одного изотопа 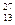 А1 (100%).
А1 (100%).
В XVI веке немецкий врач и естествоиспытатель Парацельс Филипп Ауреол Теофраст Бомбаст фон Гогенгейм, исследуя различные вещества и минералы, в том числе квасцы, установил, что они «есть соль некоторой квасцовой земли», в состав которой входит окись неизвестного металла, впоследствии названной глиноземом.
Квасцы, заинтересовавшие Парацельса, были известны с давних времен. По свидетельству греческого историка Геродота, жившего в V веке до нашей эры, древние народы применяли при крашении тканей для закрепления их цвета минеральную породу, которую они называли «алюмен», т. е. «вяжущая». Это и были квасцы.
Примерно к VIII - IX векам нашей эры относятся первые упоминания об использовании квасцов в Древней Руси также для окраски тканей и приготовления сафьяновых кож.
В 1754 году немецкий химик Маргграф сумел выделить «квасцовую землю», о которой 200 лет до этого писал Парацельс. Прошло еще несколько десятков лет, прежде чем англичанин Дэви попытался получить металл, скрывающийся в квасцах. В 1807 году ему удалось электролизом щелочей выделить натрий и калий. Данным же способом он пытался разложить глинозем для получения еще неизвестного металла, который по его предположению входил в состав глины. Но сделать этого он так и не сумел. Подобные же попытки предпринял спустя несколько лет швед Берцелиус, но и его работы не увенчались успехом. Несмотря на это, ученые все же решили дать «неподдающемуся» металлу имя: сначала Берцелиус назвал его алюмием, а затем Дэви изменил на алюминий, которое и происходит от латинского слова «алюмен» - наименования квасцов, содержащих его. В России до второй половины XIX века данный элемент называли глинием.
Первым, кому удалось, получить чистый алюминий, был датский ученый Эрстед. В 1825 году в одном из химических журналов он опубликовал свою статью, в которой писал, что в результате проведенных им опытов образовался «кусок металла с цветом и блеском, несколько похожим на олово». Однако журнал этот был не очень известен, и сообщение Эрстеда осталось почти незамеченным в научном мире. Да и сам ученый, поглощенный работами по электромагнетизму, не придал своему открытию большого значения.
В конце 1827 года немецкий химик Велер опубликовал свой способ получения нового металла. Правда, данный метод позволял ученому выделять алюминий лишь в виде зерен величиной с булавочную головку. На получение металла в виде компактной массы ему потребовалось еще 18 лет.
И лишь в 1855 году на Всемирной выставке в Париже было представлено «серебро из глины», так тогда назвали алюминий, в виде пластин и слитков, полученных французским ученым и промышленником Сент-Клер-Девилем, который разработал новый способ производства алюминия в больших количествах, положив в основу метод Велера.
Важной вехой в истории алюминия стал 1886 год, когда независимо друг от друга американский студент Холл и французский инженер Эру разработали электролитический способ производства этого металла. Идея была не нова: еще в 1854 году немецкий ученый Бунзен высказал мысль о получении алюминия электролизом его солей. Но прошло более тридцати лет, прежде чем она получила практическое воплощение. И сегодня, спустя более ста лет со дня этого события, без электролиза немыслимо производство металла.
В настоящее время алюминий получают лишь электролитическим путем. Из-за его химической активности промышленным способом производства металлического алюминия является электролиз расплава криолита, в котором растворен оксид алюминия. Процесс осуществляется при 950 °С.
Электролизер, используемый для получения металла, представляет собой стальную ванну, выложенную изнутри огнеупорным кирпичом и графитовыми блоками (рис. 1.83). Блок, находящийся на дне печи, используется в качестве катода. Над ним в процессе электролиза собирается жидкий алюминий, который периодически отводится из ванны. Анодами служат графитовые электроды, сгорающие по мере протекания процесса. Поэтому они постепенно опускаются вниз.
В печь вводят криолит, расплавляют его, затем растворяют в нем оксид алюминия. Одним из основных требований процесса является обезвоженность сырья, так как при наличии воды криолит может полностью гидролизоваться. И тогда согласно теории в результате электролиза на катоде вместо алюминия будет выделяться водород.
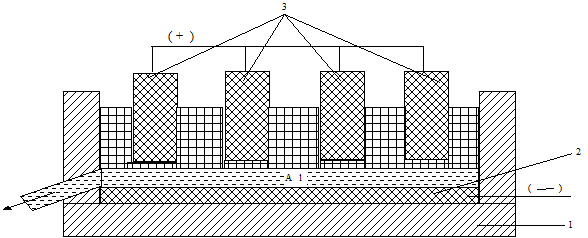
Рис. 1.83 - Схема электролизера для получения алюминия: 1 - корпус электролитической ванны; 2 - графитовый катод; 3 - графитовые аноды
Условия процесса подбираются так, чтобы на катоде выделялся свободный алюминий, а на аноде происходило образование его оксида по следующей схеме:
 катод (–) Al3+ +3е- ® Al 4
катод (–) Al3+ +3е- ® Al 4
анод (+) 4AlO  - 12e- ® 2Al2O3 + 3О2 1
- 12e- ® 2Al2O3 + 3О2 1

 4Al3+ + 4AlO
4Al3+ + 4AlO  ® Al + 2Al2O3 + 3О2 или 2Al2O3 ® 4Al + 3О2
® Al + 2Al2O3 + 3О2 или 2Al2O3 ® 4Al + 3О2
Кислород, образующийся при электролизе, сжигает графитовые аноды с выделением углекислого и угарного газов.
Получаемый технический алюминий подвергают очистке. Важнейшим методом очистки алюминия является электрорафинирование - электролиз расплавов солей с растворимым анодом (рис. 1.84). Анод помещается на дне электролизера. Он состоит из графитового блока и неочищенного алюминия, сплавленного с медью. Данная операция проводится специально, чтобы металл был тяжелее электролита и располагался на дне ванны. Электролитом служит смесь расплавленных фторидов и хлоридов алюминия, шелочных и щелочноземельных металлов (AlF2, NaF, ВаСl2).
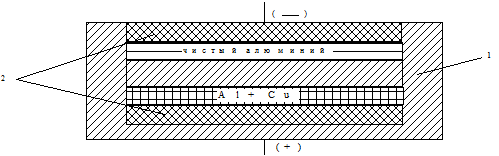
Рис. 1.84 - Схема электролизера для рафинирования алюминия: 1 - корпус электролитической ванны; 2 - графитовые блоки
Плотность этой смеси меньше, чем у сплава меди с алюминием, но больше, чем у чистого алюминия, поэтому электролит располагается над слоем технического алюминия. Над электролитом находится графитовый катод. Чистый алюминий выделяется в жидком виде на графитовом катоде и остается вверху электролизера, так как имеет наименьшую плотность из всех жидких компонентов, находящихся в электролизере.
Условия электролиза таковы, что на аноде растворяется, а на катоде образуется только чистый алюминий. Примеси других металлов, которые имеют по сравнению с алюминием более положительные электродные потенциалы (железо, медь, титан), не растворяются и не выделяются на катоде. Методом электрорафинирования может быть получен алюминий с массовой долей примесей меньше 0,1 %.
Алюминий представляет собой серебристо-белый металл, который не имеет полиморфных модификаций и кристаллизуется только в кубической гранецентрированной решетке с периодом (а) равным 0,4041 нм (рис. 1.85). Он легкоплавкий (температура плавления 660 °С) и механически прочный.

Рис. 1.85 - Элементарная кристаллическая решетка алюминия
Наиболее важной характеристикой металла является достаточно низкая плотность: 2,7 против 7,8 для железа и 8,9 г/см3 для меди, т. е. он относится к легким металлам. Алюминий обладает высокой электро- и теплопроводностью, но при этом уступает меди. Так удельное сопротивление алюминия r и его теплопроводность l равны соответственно 0,0116 мкОм·м и 238 ккал/м·град·ч, что составляет 65 % от таковых у меди (табл. 1.8). Он легко поддается обработке: прокатывается в фольгу, вытягивается в тонкую проволоку, отливается. Вследствие этого технический алюминий выпускается в виде листов, профилей, прутков, проволоки и других полуфабрикатов. При 600 °С алюминий становится хрупким и его можно истолочь в зерна или порошок. Чистый металл имеет высокую коррозионную стойкость. Чем он чище, тем выше данная характеристика.
В зависимости от чистоты различают алюминий особой А999 (99,999 % А1), высокой А995 (99,995 % А1), А99 (99,99 % А1), А97 (99,97 % А1), А95 (99,95 % А1) и технической чистоты А85, А8, А7, А6, А5, АО (99,0 % А1).
Табл. 1.8 - Физико-механические параметры алюминия
| Параметр | Значение |
| Плотность, г/см3 | 2,7 |
| Температура плавления, °C | 658,9 - 660 |
| Скрытая теплота плавления, кал/г | 92,4 |
| Температура кипения, °С | |
| Нормальный потенциал Э0 = Э1+ + е, эВ | 5,984 |
| Удельная теплоемкость при 20 °С, кал/г·град | 0,222 |
| Коэффициент линейного расширения, град-1 | 23,8·10-6 |
| Теплопроводность, кал/см·сек·град (Н2О = 1) | 0,52 - 0,54 |
| Удельное электросопротивление, ом·м | 2,7·10-4 |
| Предел ползучести при 15 °С, кГ/мм2 | 5,0 |
| Предел прочности при сжатии литого металла, кГ/мм2 | 42,0 |
| Ударная вязкость литого металла, кГ·м/см2 | 14,0 |
| Предел упругости отожженного металла, кГ/мм2 | 3,0 - 4,0 |
| Модуль нормальной упругости, кГ/мм2 | 7,1 |
| Модуль сдвига, кГ/мм2 | |
| Временное сопротивление, кГ/мм2: деформированного отожженного | 15,0 8,0 |
| Предел текучести, кГ/мм2: деформированного отожженного | 12,0 5,0 - 8,0 |
| Относительное удлинение, %: деформированного отожженного | 5,0 - 10,0 30,0 - 40,0 |
| Относительное сужение, %: деформированного отожженного | 50,0 - 60,0 70,0 - 90,0 |
| Твердость НВ (алмаз = 10), кГ/мм2: деформированного отожженного литого | 25,0 - 35,0 13,0 - 20,0 13,0 - 25,0 |
Отожженный металл высокой чистоты имеет сравнительно низкую прочность sв = 50 МПа, s0,2 = 15 МПа и большую пластичность d = 50 %. Благодаря последней он легко обрабатывается давлением, сваривается всеми видами сварки, но обработка резанием затруднена из-за образования задиров. Алюминий высокой чистоты марок А999 и А995 применяют в производстве анодной и катодной фольги электролитических конденсаторов и в микроэлектронике для получения тонких пленок. Менее чистый алюминий марок А97 и А95 используют для корпусов электролитических конденсаторов, статорных и роторных пластин воздушных конденсаторов. Короткозамкнутые роторы асинхронных электродвигателей общего назначения обычно изготовляются из алюминия марок А5 или А7.
Алюминий является сильным восстановителем. Это химически активный металл. В ряду напряжений он располагается до водорода. Металл легко соединяется с кислородом уже при обычной температуре. В результате этого его поверхность покрывается окисной пленкой Аl2O3, предохраняющей металл от дальнейшего окисления. Толщина пленки составляет 0,00001 мм. Она прочна, тверда и гибка, не отстает при растягивании, сжатии, закручивании и изгибе и придает поверхности металла матовый вид. Благодаря этому металл не разрушается (не корродирует) от влаги и воздуха. При нормальных условиях алюминий реагирует с хлором и бромом, а при нагревании взаимодействует с такими неметаллами как азот, углерод и йод. Сероводород, сернистый газ, аммиак и другие газы, имеющиеся в воздухе, не влияют на коррозию металла при комнатной температуре, а пар, дистиллированная и чистая пресная вода – и при высоких температурах. Большой стойкостью обладает алюминий к органическим кислотам, таким как уксусная, лимонная, винная, пропионовая и яблочная. При обычной температуре он практически не взаимодействует c концентрированными азотной (HNO3) и серной (H2SO4) кислотами. Это связано с образованием на поверхности металла защитной окисной пленки. Поэтому данные кислоты хранят и перевозят в алюминиевой таре. Однако разбавленная азотная кислота сильно его разрушает. После снятия с поверхности металла защитной оксидной пленки (например, натиранием наждачным порошком или полотном), он взаимодействует с фторо-, хлоро- и бромоводородными (HF, HCl, HBr) и разбавленной (< 10 %) серной кислотами с вытеснением из них газообразного водорода и формированием соответствующих солей. При удалении пленки он также энергично реагирует с водой с образованием гидроксида и бурным выделение водорода. В отличие от многих металлов на алюминий очень сильно действуют растворы щелочей, их реагирование протекает с выделением водорода. Реакция со щелочами осуществляется благодаря легкости растворения в них оксидной пленки. В связи с этим в алюминиевой посуде или таре нельзя хранить щелочи и щелочные растворы. На основании данного свойства по предложению химика А. И. Горбова в русско-японскую войну взаимодействием алюминия со щелочью получали водород для аэростатов, что связано было с легкостью перевозки исходных веществ.
Физические и химические свойства алюминия обусловили его широкое применение в технике.
В связи с высокой тепло- и электропроводимостью алюминий используют в качестве проводниковых материалов. Он является вторым по значению (после меди) проводниковым материалом. При одинаковой электропроводности масса изделий из алюминия в два раза меньше, чем у соответствующих медных деталей.
Пророческими оказались слова Н. Г. Чернышевского: «Этому металлу суждено великое будущее» и инженера Н. Жукова: «Алюминий призван занять выдающееся место в технике и заместить собой, если не все, то многие из обыденных металлов».
Так оно и есть, по объему производства среди металлов он занимает второе место после железа. Металлический алюминий широко используется в металлургии. Он употребляется при выплавке стали в качестве раскислителя для удаления из нее избыточного кислорода. Алюминий применяют для алюмотермического получения некоторых трудновосстановимых тугоплавких металлов (вольфрама, марганца, ванадия, хрома других), щелочных и щелочноземельных элементов (кальция, лития, бария и других), а также для производства специальных сталей. Технический алюминий употребляется для ненагруженных конструкций, когда требуется значительная пластичность, хорошая свариваемость, сопротивление коррозии и высокая тепло- и электропроводность. Он используется в воздушных линиях электропередачи, а также и в производстве изолированных кабельных изделий. Для электротехнических целей применяется алюминий марки А1, содержащий не более 0,5 % примесей. Еще более чистый металл марки АВ00 (до 0,03 % примесей) употребляют для изготовления фольги, электродов и корпусов электролитических конденсаторов.
Смесь порошков алюминия и оксидов железа (Fe2O3 или Fe3O4), имеющая название термит, используется для сварки стальных изделий (трубопроводов, рельсов). При горении термитной смеси протекает реакция с большим выделением теплоты, за счет которой температура может достигать 3500 °С. Широко употребляется термитная сварка рельсов, железных и стальных труб.
Крупным потребителем металла является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов, а авиационный мотор - на 1/4. Поэтому этот элемент называют «крылатым металлом» или говорят, что «алюминий летает».
В машиностроении, учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты, корпуса автобусов, троллейбусов и цельнометаллических вагонов.
Ученые установили, что алюминий обладает еще одним ценным свойством: он не разрушает витамины. Поэтому из него изготовляют аппаратуру для маслобойной, сахарной, кондитерской, пивоваренной промышленности. Также в пищевой промышленности из него изготовляют упаковку и посуду. Для туриста лучший чайник алюминиевый, в нем быстрее закипает вода.
Прочные позиции завоевал этот металл и в строительстве. Еще в 1890 году в одном из американских городов алюминий был впервые применен при постройке жилого дома. Спустя полстолетия все алюминиевые детали находились в прекрасном состоянии. Первая алюминиевая крыша, поставленная в 1897 году, стоит без ремонта и по сей день. Алюминий и его сплавы необходимы для танкостроения, артиллерии, изготовления взрывчатых веществ, осветительных и зажигательных снарядов. Пудра из алюминия служит в качестве серебристой краски для защиты железных изделий от коррозии. Однако ввиду низкой прочности и незначительной упрочняемости технически чистый алюминий применяют крайне редко, но широкое использование нашли его сплавы. Поэтому основная масса алюминия идет на их производство.
Алюминий является хорошим восстановителем многих оксидов металлов, т. е. он сам окисляется до своего оксида, а соответствующий металл восстанавливается до свободного состояния. Реакции начинаются при высокой температуре и протекают с выделением большого количества теплоты, температура может достигать 2500 - 3000 °С. В этих условиях восстановленный металл получается в жидком состоянии, а на его поверхность всплывает окись алюминия в виде шлака. Метод восстановления оксидов металлов алюминием получил название алюмино- или алюмотермии. Он является разновидностью металлотермии. Алюмотермический метод был предложен русским химиком Н. Н. Бекетовым в 1865 году.
По объему производства среди металлов алюминий занимает второе место после железа. Металлический алюминий широко используется в металлургии. Он употребляется при выплавке стали в качестве раскислителя для удаления из нее избыточного кислорода. Алюминий применяют для алюмотермического получения некоторых трудновосстановимых тугоплавких металлов (вольфрама, марганца, ванадия, хрома других), щелочных и щелочноземельных элементов (кальция, лития, бария и других), а также для производства специальных сталей. Технический алюминий употребляется для ненагруженных конструкций, когда требуется значительная пластичность, хорошая свариваемость, сопротивление коррозии и высокая тепло- и электропроводность. Он используется в воздушных линиях электропередачи, а также и в производстве изолированных кабельных изделий. Для электротехнических целей применяется алюминий марки А1, содержащий не более 0,5 % примесей. Еще более чистый металл марки АВ00 (до 0,03 % примесей) употребляют для изготовления фольги, электродов и корпусов электролитических конденсаторов.
Основные достоинства всех сплавов алюминия: малая плотность (2,5 - 2,8 г/см3), высокая прочность (в расчете на единицу веса), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработка. Алюминиевые сплавы экономичны, легкодоступны, прочны при низких температурах и легко обрабатываемы (они легко куются, штампуются, пригодны для глубокой вытяжки, волочения, экструдирования, литья, хорошо свариваются и обрабатываются на металлорежущих станках). К сожалению, механические свойства всех алюминиевых сплавов начинают заметно ухудшаться при температурах выше 175° С. Благодаря образованию защитной оксидной пленки они проявляют хорошую коррозионную стойкость в большинстве обычных агрессивных сред. Эти сплавы хорошо проводят электричество и тепло, обладают высокой отражательной способностью, немагнитны, безвредны в контакте с пищевыми продуктами (поскольку продукты коррозии бесцветны, не имеют вкуса и нетоксичны), взрывобезопасны (поскольку не дают искр) и хорошо поглощают ударные нагрузки. Благодаря такому сочетанию свойств алюминиевые сплавы служат хорошими материалами для легких поршней, применяются в вагоно-, автомобиле- и самолетостроении, в пищевой промышленности, в качестве архитектурно-отделочных материалов, в производстве осветительных отражателей, технологических и бытовых кабелепроводов, при прокладке высоковольтных линий электропередачи. Примесь железа, от которой трудно избавиться, повышает прочность алюминия при высоких температурах, но снижает коррозионную стойкость и пластичность при комнатной температуре. Кобальт, хром и марганец ослабляют охрупчивающее действие железа и повышают коррозионную стойкость. При добавлении лития к алюминию повышаются модуль упругости и прочность, что делает такой сплав весьма привлекательным для авиакосмической промышленности. К сожалению, при своем превосходном отношении предела прочности к массе (удельной прочности) сплавы алюминия с литием обладают низкой пластичностью.
В качестве основных легирующих элементов алюминиевых сплавов применяют медь, марганец, кремний, магний, цинк; реже - литий, никель, титан, бериллий и цирконий. Многие из них образуют с алюминием твердые растворы ограниченной переменной растворимости и промежуточные фазы - интерметаллиды - CuAl2, Mg2Si и др. (рис. 1.86).
Многофазная структура позволяет подвергать алюминиевые сплавы упрочняющей термической обработке.
Дуралюмин (дюраль, дюралюминий). Его изобретателем является известный немецкий ученый А. Вильм. Он получил патент и вскоре продал сплав одной немецкой фирме, которая в 1911 году выпустила его первую промышленную партию. Свое первое имя дюралюминий он получил в честь города Дюрена, где было начато его промышленное производство. Позже его стали называть дуралюмином. Данное название можно расшифровать как твердый алюминий (по-французски Dur – твердый и aluminium - алюминий).
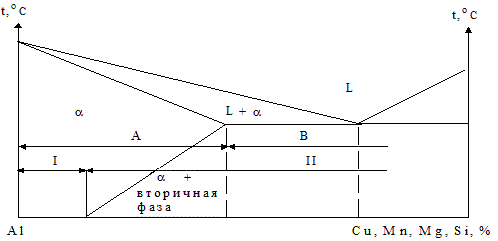
Рис. 1.86 - Диаграмма состояния «алюминий - легирующий элемент» (схема): сплавы А - деформируемые; В - литейные; I - неупрочняемые и II - упрочняемые термообработкой
В Советском Союзе в 20-х годах инженер-металлург В. А. Буталов разработал отечественный вариант дуралюмина, названный кольчугалюминием. Промышленное производство последнего было организовано в поселке (ныне городе) Кольчугино Владимирской области. Из кольчугалюминия был сделан первый советский металлический самолет АНТ-2 конструкции А. Н. Туполева.
Дюралюминий представляет собой систему на алюминиевой основе, в которую в качестве основной добавки вводится медь (от 1,4 до 13 % масс), а также в небольших концентрациях магний (от 0,2 до 2,8 % масс) и марганец (от 0,2 до 1 % масс). В некоторых случаях в состав сплавов добавляют 0,5 - 6,0 % Si, 5 - 7 % Zn, 0,8 - 1,8 % Fe и 0,02 - 0,35 % Ti. Остальные присутствующие элементы являются случайными примесями, попадающими в сплав в процессе производства.
Дуралюмины - очень легкие, наиболее прочные и наименее коррозионно-стойкие из алюминиевых сплавов. Они склонны к межкристаллической коррозии. Для защиты листового дюралюминия от коррозии его поверхность плакируют чистым алюминием. Они не обладают хорошей свариваемостью, но благодаря своим остальным характеристикам применяются везде, где необходима прочность и легкость. Дюрали относятся к деформируемым сплавам упрочняемым термической обработкой (рис. 1.87). Наибольшее применение дуралюмины нашли только как конструкционный материал в авиа- и машиностроении, в частности, в авиастроении для изготовления некоторых деталей турбореактивных двигателей.
|
|
|
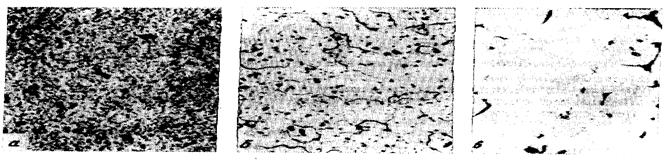
Рис. 1.87 - Микроструктура дюралюминия в состояниях: а – отожженном, б – закаленном, в - перегретом при закалке
Магналии - это сплавы алюминия с магнием. Основными добавками являются кремний (от 0,5 до 1,3 %) и марганец (от 0,1 до 1,0 %), все остальное составляет алюминий. Хорошие механические свойства, легкие, превосходная коррозионная стойкость. Магналии или магналины - названы так из-за большого содержания в них магния. Основной легирующей добавкой является марганец (0,2 - 1,6 % Mn). В редких случаях в качестве вторых основных легирующих добавок служат 3,5 - 4,5% Zn и 1,75 - 2,25 % Ni. В небольших концентрациях вводят титан (0,05 - 0,15 %), бериллий (0,02 - 0,15 %) и цирконий (0,05 - 0,2 %). Магналии отличаются высокой прочностью и устойчивостью к коррозии в пресной и даже морской воде. Они также хорошо устойчивы к воздействию азотной кислоты HNO3 , разбавленной серной кислоты H2SO4, ортофосфорной кислоты H3PO4, а также в средах, содержащих SO2 При концентрации Mg выше 6 % магналии склонны к межкристаллической коррозии. Обладают более низкими литейными свойствами, чем силумины. Магналии не упрочняются термической обработкой. В зависимости от технологии изготовления и содержания магния их прочность меняется от 8 до 38 кг/мм2. При температуре жидкого водорода они хрупки, но в среде жидкого кислорода и сжиженных горючих газов работают вполне успешно. Области их применения весьма обширны. В частности, они прекрасно зарекомендовали себя в судостроении: из магналиев изготовлены корпуса судов на подводных крыльях – «Ракет» и «Метеоров». Используют их и в конструкциях некоторых ракет. Применяются как конструкционный материал в авиа-, судо- и машиностроении (сварные баки, заклепки, бензопроводы, маслопроводы); для изготовления арматуры строительных сооружений; при производстве деталей холодильных установок; для изготовления декоративных бытовых предметов, кухонной и молочной посуды и пр. Из них также производят фасонные отливки (литейные магналии), листы, проволоку, заклепки и т. д. (деформируемые магналии). Особо следует отметить возможность использования малолегированных магналиев для упаковки пищевых продуктов. Консервные банки, обертка для сыров, фольга для тушения мяса, банки для пива, крышки для бутылок с молочнокислыми продуктами – вот не полный перечень околопищевых применений этих сплавов. Скоро в нашей стране алюминиевые консервные банки будут выпускаться миллиардами штук, и тогда определение Александра Евгеньевича Ферсмана – «металл консервной банки» – перейдет от олова к алюминию. Магналины как материалы электротехники применяются для изготовления стрелок различных электрорадиотехнических приборов, токопроводящих шин, фольги, роторов асинхронных электродвигателей и других подобных изделий.
Силумины это сплавы алюминия с кремнием (от 3 до 26 %), основные легирующие металлы - магний (от 0,2 до 1,3 %) и марганец (от 0,2 до 0,9 %). Иногда вводят 1 -4 % Cu, 2 – 4 % Zn , 0,8 – 2 % Ni , 0,1 - 0,4 % Cr , 0,05 - 0,3 % Ti (рис. 1.88).
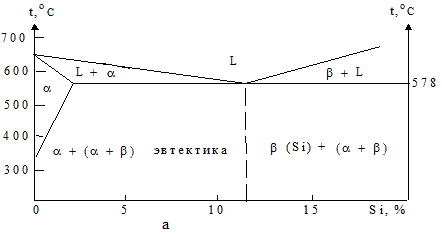
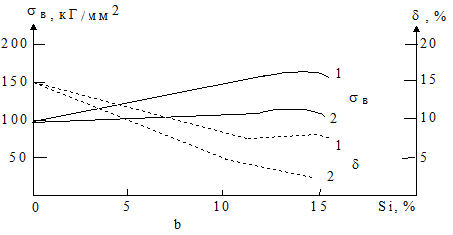
Рис. 1.88 - Диаграмма состояния сплавов системы А1 - Si (а) и зависимости их механических свойств от концентрации кремния (б): 1 – модифицированные и 2 - немодифицированные.
Силумины являются первыми алюминиевыми сплавами. Но их свойства были неудовлетворительны и потому долгое время считали, что добавка кремния алюминию вредна. При своих относительно невысоких прочностных характеристиках силумины обладают наилучшими из всех алюминиевых сплавов литейными свойствами, являются газоплотным материалом. Силумины - самые широко распространенные литейные системы и обладают большей жаропрочностью в немодифицированном состоянии, чем в модифицированном (рис. 1.89). Они также имеют высокую жидкотекучесть, не склонны к образованию горячих трещин (даже в местах перехода от массивных течений к тонким), отливки из силуминов характеризуются хорошей герметичностью.
|
|
|
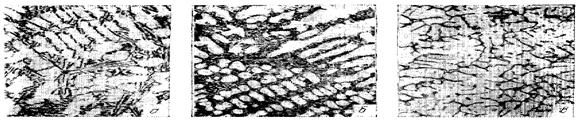
Рис. 1.89 - Микроструктура литейных сплавов алюминия: а - немодифицированный силумин; б – модифицированный силумин; в - типичная структура дюралюминиевого сплава (А1 + 12 % Сu) для литья
По коррозионной стойкости занимают промежуточное положение между дуралюминами и магналиями. Хорошо противостоят вибрационным нагрузкам. Они наиболее часто используются там, где необходимо изготовить тонкостенные или сложные по форме детали. Нашли свое основное применение как конструкционный материал в: авиастроении; вагоностроении; автомобилестроении и строительстве сельскохозяйственных машин для изготовления картеров, деталей колес, корпусов и деталей приборов.
В качестве ЭТМ силумины широко употребляются для корпусов воздушных конденсаторов. Припои на основе алюминия с кремнием (4,0 - 13,0 %) обладают очень высокой коррозионной стойкостью. Они имеют температуру плавления 525 - 577 °С и применяются для пайки сплавов АВ, АМц, АМг и др. Однако данные припои не пригодны для паяния материалов на основе дуралюминов - Д1, Д16 и др., не допускающих нагрева выше 505 °С. Введение в состав сплавов цинка и германия значительно снижает температуру плавления образующихся систем и позволяет использовать их в качестве припоев для пайки дюралюминиевых изделий.
САП - сплавы, состоящие из Al и 20-22% Al2O3. Получают спеканием окисленного алюминиевого порошка. После спекания частицы Al2O3 играют роль упрочнителя. Прочность данного соединения при комнатной температуре ниже, чем у дуралюминов и магналиев, но при температуре превышающей 200 °С превосходит их. При этом САП обладают повышенной стойкостью к окислению, поэтому они незаменимы там, где температура эксплуатации превышает 400 °С.
Существуют еще спеченные сплавы алюминия с кремнием, никелем, железом, хромом, цирконием. Они называются САС – по первым буквам слов «спеченный алюминиевый сплав». Сплавы имеют низкий коэффициент линейного расширения, и это позволяет использовать их в сочетании со сталью в механизмах и приборах. У обычного же алюминия коэффициент линейного расширения примерно вдвое выше, чем у стали, и это вызывает большие напряжения, искажения размеров и нарушения прочности.
По широте применения сплавы алюминия занимают второе место после стали и чугуна. Благодаря приведенному сочетанию свойств алюминиевые сплавы служат хорошими материалами для легких поршней, применяются в вагоно-, автомобиле- и самолетостроении, в пищевой промышленности, в качестве архитектурно-отделочных материалов, в производстве осветительных отражателей, технологических и бытовых кабелепроводов, при прокладке высоковольтных линий электропередачи. Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды, спорттоваров, мебели, рекламе и других отраслях промышленности.
Все технические сплавы на алюминиевой основе принято разделять на деформируемые (после прессования, прокатки, ковки) и литые (литейные).
Деформируемыми сплавами являются все алюминиевые системы, кроме силуминов. Деформируемые сплавы делят на упрочняемые и не упрочняемые термической обработкой. По технологическим особенностям, назначению, физическим и коррозионным свойствам алюминиевые деформируемые сплавы классифицируют на коррозионно-стойкие, декоративные, заклепочные, ковочные, жаропрочные, со специальными свойствами и самозакаливающиеся. В зависимости от уровня прочности различают сплавы низкой, средней и высокой прочности.
Литейные алюминиевые сплавы для фасонного литья должны обладать высокой жидкотекучестью, сравнительно небольшой усадкой, малой склонностью к образованию горячих трещин и к пористости в сочетании с хорошими механическими свойствами и сопротивлением коррозии. Высокие литейные свойства имеют сплавы, имеющие в структуре эвтектику (a + b), образующуюся при содержании легирующих элементов с большей предельной растворимостью в алюминии. Поэтому количество модифицирующих компонентов в литейных сплавах выше, чем в деформируемых. Системы Al - Si, Al - Cu, Al - Mg дополнительно легируют медью и магнием (Al - Si), кремнием (А1 - Mg), марганцем, никелем, хромом (Al - Cu). Для улучшения механических свойств путем измельчения зерна вводят также титан, цирконий, бор и ванадий. По назначению конструкционные литейные сплавы можно условно разделить на системы высокой и средней прочности, жаропрочные и коррозионно-стойкие.
Вопросы для самопроверки
1. В виде каких минералов алюминий встречается в природе? Какие из них являются сырьем для его получения?
2. Опишите современную технологию производства чистого алюминия. Какой способ в данном случае играет главенствующую роль?
3. Перечислите характерные физико-механические свойства чистого алюминия и свяжите с ними области применения данного металла?
4. Какое свойство алюминия лежит в основе алюминотермического способа получения чистых металлов?
5. Объясните с чем связана коррозионная стойкость алюминия в различных агрессивных средах? Как это влияет на его применение?
6. Почему в алюминиевой посуде нельзя хранить щелочь? Как это свойство использовал русский химик А. И. Горбов?
7. Почему в алюминиевом чайнике вода закипает быстрее?
8. Каковы технологические параметры алюминиевых сплавов?
9. Перечислите элементы периодической системы Д. И. Менделеева применяемые в качестве компонентов в алюминиевых сплавах. Как они влияют на свойства систем?
10. Охарактеризуйте в общем виде структуру и состав известных алюминиевых сплавов. Приведите их диаграммы состояния?
11. Деформируемые сплавы. Какие из существующих систем алюминий – химический элемент сюда относятся и на какие классы они подразделяются? Почему они не упрочняются термообработкой?
12. Опишите физико-механические и химические свойства деформируемых сплавов и укажите их области применения.
13. Литейные сплавы. Как они классифицируются по химическому составу? Перечислите какими технологическими параметрами должны обладать данные сплавы? Какие металлы вводят в качестве легирующих добавок к основным компонентам и для чего?
14. На какие группы по назначению подразделяют литейные алюминиевые сплавы? Охарактеризуйте кратко их физико-химические и механические свойства?
15. Спеченные алюминиевые материалы. Охарактеризуйте их. На какие две группы они подразделяются? Где данные материалы применяются?
Дата добавления: 2015-09-21; просмотров: 4312;
