Сили міжмолекулярної взаємодії. Агрегатні стани речовини
 Атоми і молекули речовини перебувають у безупинному русі і взаємодіють між собою з силами притягання і відштовхування. Дослідження взаємодії між атомами і молекулами речовини засвідчує, що на достатньо великих відстанях між ними діють сили притягання, а на малих – сили відштов-хування. За природою це сили електро-магнітного походження.
Атоми і молекули речовини перебувають у безупинному русі і взаємодіють між собою з силами притягання і відштовхування. Дослідження взаємодії між атомами і молекулами речовини засвідчує, що на достатньо великих відстанях між ними діють сили притягання, а на малих – сили відштов-хування. За природою це сили електро-магнітного походження.
Загалом, молекули речовини мають кінетичну енергію та потенціальну енер-гію взаємодії. Співвідношення між кіне-тичною та потенціальною енергією моле-кул визначають, у якому агрегатному стані перебуває речовина. Якщо сумарна кінетична енергія поступального руху молекул є більшою від потенціальної енергії їхньої взаємодії (  >>
>> 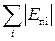 ), то речовина перебуває в газоподібному стані, якщо (
), то речовина перебуває в газоподібному стані, якщо (  <<
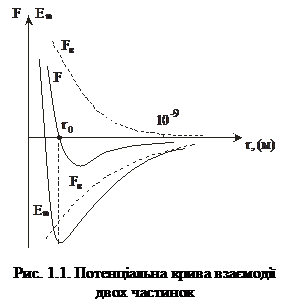
<< 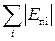 ), – то це твердий стан. Умовою рідкого стану речовини є те, що ці енергії приблизно дорівнюють одна одній. На рис. 1.1 показано залежності сили взаємодії та потенціальної енергії взаємодії двох молекул від відстані між ними. Відстані r0 відповідає мінімум Еп(r), отже, на відстані r =
), – то це твердий стан. Умовою рідкого стану речовини є те, що ці енергії приблизно дорівнюють одна одній. На рис. 1.1 показано залежності сили взаємодії та потенціальної енергії взаємодії двох молекул від відстані між ними. Відстані r0 відповідає мінімум Еп(r), отже, на відстані r =
= r0 молекули перебувають у рівноважному стані. Оскільки сила взаємодії 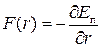 , то очевидно, що F(r0)=0. Якщо r>r0, то між молекулами переважають сили притягання, якщо r<r0 – то сили відштовхування.
, то очевидно, що F(r0)=0. Якщо r>r0, то між молекулами переважають сили притягання, якщо r<r0 – то сили відштовхування.
У газоподібному стані відстані між молекулами речовини достатньо великі (r>>r0), тому взаємодія між ними доволі слабка. Це зумовлює відсутність форми і власного об’єму газів.
У рідині відстані між атомами і молекулами є близько r0, тому рідина має власний об’єм, однак власної форми не має. Для рідин характерний ближній порядок у розміщенні атомів. Тобто атом оточений певною кількістю впорядковано розміщених найближчих сусідів. Положення кожного атома чи молекули у рідині не є чітко визначеним, і вони можуть постійно переміщуватись в об’ємі рідини.
У твердому стані речовина має власний об’єм і сталу форму. Атоми і молекули можуть виконувати лише коливні рухи відносно своїх положень рівноваги, а переміщення атомів по об’єму ускладнене. Є два типи твердих тіл – аморфні й кристалічні. В аморфних тілах порядок розміщення атомів подібний до рідини, однак сили взаємодії між ними значно більші. У кристалічних тілах існує дальній порядок розміщення. Атоми перебувають у чітко фіксованих положеннях, які утворюють так звані елементарні комірки.
Розглянемо детальніше сили міжатомної та між молекулярної взаємо-дії. Відомо, що атом у цілому електронейтральний. Водночас сили, які утримують атоми в молекулі, є електромагнітними. Загалом існує два типи зв’язків атомів у молекулі – це іонний зв’язок і ковалентний зв’язок.
Іонний зв’язок виникає тоді, коли під час утворення молекули атоми речовини можуть легко втрачати (або приєднувати) один або ж декілька електронів, перетворюючись у додатні та від’ємні іони. Між такими іонами виникають кулонівські сили взаємного притягання, які й забезпечують утворення молекули. Прикладами молекул з іонним зв’язком є NaCl, NaJ, KBr та ін. За умови іонного зв’язку між іонами відбувається повний обмін зарядом, кратний до заряду електрона.
 Ковалентний зв’язок виникає тоді, коли атоми, об’єднуючись у молекулу, лише частково обмінюються зарядом. Прикладами молекул з ковалентним зв’язком є O2, N2, CO, молекули йоду, сульфіду цинку та ін. Під час утворення таких молекул електронні хмари атомів частково перекриваються, і частина електронів стає спільною для обох атомів (рис.1.2). Під час руху цих електронів навколо обох ядер вони більшу частину часу перебувають саме між ядрами, створюючи у цій точці простору ефективний від’ємний заряд. Наявність такого заряду зумовлює виникнення сил притягання, які компенсують сили кулонівського відштовхування між ядрами атомів. Так утворюється молекула зі стійким ковалентним зв’язком. Точний розрахунок ковалентного зв’язку дає квантова механіка.
Ковалентний зв’язок виникає тоді, коли атоми, об’єднуючись у молекулу, лише частково обмінюються зарядом. Прикладами молекул з ковалентним зв’язком є O2, N2, CO, молекули йоду, сульфіду цинку та ін. Під час утворення таких молекул електронні хмари атомів частково перекриваються, і частина електронів стає спільною для обох атомів (рис.1.2). Під час руху цих електронів навколо обох ядер вони більшу частину часу перебувають саме між ядрами, створюючи у цій точці простору ефективний від’ємний заряд. Наявність такого заряду зумовлює виникнення сил притягання, які компенсують сили кулонівського відштовхування між ядрами атомів. Так утворюється молекула зі стійким ковалентним зв’язком. Точний розрахунок ковалентного зв’язку дає квантова механіка.
Іонний та ковалентний зв’язки не тільки відповідальні за утримування атомів у молекулі, а й відіграють важливу роль у створенні сил міжмолекулярної взаємодії у речовині. Іонний та ковалентний зв’язки виявляються лише тоді, коли відстані між молекулами стають достатньо малими. Саме тому вони характерні, головно для кристалічних твердих тіл, формуючи їхню кристалічну структуру. З огляду на це кристали поділяють на іонні та ковалентні. Сили іонного та ковалентного зв’язків достатньо великі, що зумовлює міцність та низку інших властивостей кристалічних тіл.
Різновидом ковалентного зв’язку в кристалах є металевий зв’язок, за якого валентні електрони всіх атомів кристала стають вільними і колективізованими, утворюючи електронний газ, який заповнює кристалічну ґратку. У вузлах кристалічної ґратки містяться позитивно заряджені іони, які, взаємодіючи з колективізованими електронами, утворюють стійку структуру кристала. Металевий зв’язок характерний, здебільшого, для кристалів, що містять атоми одного сорту (мідь, золото, срібло тощо). Енергія металевого зв’язку значно менша від енергії ковалентного та іонного зв’язків. Свідченням цього є, зокрема, нижча температура плавлення металів порівняно з іонними та ковалентними кристалами.
 Водночас у природі є велика група так званих молекулярних кристалів, у вузлах кристалічної ґратки яких містяться певним чином орієнтовані молекули. У таких кристалах міжмолекулярні зв’язки також значно слабші, ніж в іонних та ковалентних. Це зумовлено тим, що відстані між молекулами у таких кристалах достатньо великі, і їхню взаємодію забезпечують сили Ван-дер-Ваальса. Ван-дер-ваальсівський зв’язок між молекулами характерний не лише для молекулярних крис-талів, а й для рідин та газів. З огляду на це розглянемо детальніше природу ван-дер-ваальсівських сил. Ці сили виникають унаслідок того, що за умови швидкого зміщення додатних і від’ємних зарядів нейтральна молекула перетворюється в диполь (поляризується). Для диполя характерний диполь-ний момент, який дорівнює добутку заряду на відстань між зарядами. Навколо диполя виникає електричне поле, яке взаємодіє з полями інших диполів. Під час зближення двох диполів вони завжди намагаються зорієнту-ватись так, щоб заряди протилежного знака були найближче (рис. 1.3).
Водночас у природі є велика група так званих молекулярних кристалів, у вузлах кристалічної ґратки яких містяться певним чином орієнтовані молекули. У таких кристалах міжмолекулярні зв’язки також значно слабші, ніж в іонних та ковалентних. Це зумовлено тим, що відстані між молекулами у таких кристалах достатньо великі, і їхню взаємодію забезпечують сили Ван-дер-Ваальса. Ван-дер-ваальсівський зв’язок між молекулами характерний не лише для молекулярних крис-талів, а й для рідин та газів. З огляду на це розглянемо детальніше природу ван-дер-ваальсівських сил. Ці сили виникають унаслідок того, що за умови швидкого зміщення додатних і від’ємних зарядів нейтральна молекула перетворюється в диполь (поляризується). Для диполя характерний диполь-ний момент, який дорівнює добутку заряду на відстань між зарядами. Навколо диполя виникає електричне поле, яке взаємодіє з полями інших диполів. Під час зближення двох диполів вони завжди намагаються зорієнту-ватись так, щоб заряди протилежного знака були найближче (рис. 1.3).
Неважко довести, що сила електростатичної взаємодії двох диполів є силою притягання. Отже, сили Ван-дер-Ваальса також мають електро-магнітну природу і зумовлені взаємодією поляризованих молекул.
Зазначимо, що молекули низки речовин мають власний дипольний момент. Такі молекули називають полярними, а ван-дер-ваальсівські сили взаємодії між ними – дипольно орієнтаційними.
Якщо ж внутрішня будова молекул така, що вони не мають власного дипольного моменту, то їх називають неполярними. Водночас у разі зближення неполярних молекул їхні електричні поля не повністю взаємно компенсуються і вони поляризують одна одну. Подальша їхня взаємодія відбувається так, як і для полярних молекул. Сили ван-дер-ваальсівської взаємодії неполярних молекул називають дисперсійними.
Отже, сили міжмолекулярної взаємодії в речовині поділяють на сили іонного зв’язку, сили ковалентного зв’язку та сили Ван-дер-Ваальса. Ван-дер-ваальсівські сили, на відміну від двох інших, виникають за повної відсутності обміну зарядами між молекулами. Зазначимо, що всередині молекули ван-дер-ваальсівські сили не виявляються.
Дата добавления: 2015-09-02; просмотров: 1299;
