Газоподібний стан
 У газоподібному стані середня відстань між молекулами на кілька порядків перевищує розміри самих молекул. На таких відстанях, як зазначено вище, сили міжмолекулярної взаємодії практично не діють, тому молекули газу мають лише кінетичну енергію теплового руху (
У газоподібному стані середня відстань між молекулами на кілька порядків перевищує розміри самих молекул. На таких відстанях, як зазначено вище, сили міжмолекулярної взаємодії практично не діють, тому молекули газу мають лише кінетичну енергію теплового руху ( 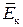 ~kT). Зокрема, у газоподібному стані
~kT). Зокрема, у газоподібному стані 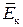 значно більша від потенціальної енергії міжмолекулярної взаємодії (
значно більша від потенціальної енергії міжмолекулярної взаємодії ( 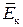 >>
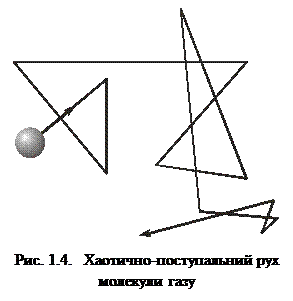
>> 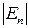 ), тому молекули газу рухаються поступально, взаємодіючи лише під час зіткнень. Зіткнення молекул зумовлюють зміни їхньої кінетичної енергії та імпульсу, тому характер руху молекул газу хаотично-поступальний (рис. 1.4). Від зіткнення до зіткнення молекули рухаються незалежно одна від одної рівномірно і прямолінійно. Такий характер руху і взаємодії молекул газу спричинює те, що речовина в газоподібному стані не зберігає своєї форми й об’єму і не має власної структури. Газоподібний стан – це безструктурний стан речовини.
), тому молекули газу рухаються поступально, взаємодіючи лише під час зіткнень. Зіткнення молекул зумовлюють зміни їхньої кінетичної енергії та імпульсу, тому характер руху молекул газу хаотично-поступальний (рис. 1.4). Від зіткнення до зіткнення молекули рухаються незалежно одна від одної рівномірно і прямолінійно. Такий характер руху і взаємодії молекул газу спричинює те, що речовина в газоподібному стані не зберігає своєї форми й об’єму і не має власної структури. Газоподібний стан – це безструктурний стан речовини.
Рідини
У рідинах середня відстань між молекулами суттєво менша, ніж у газах, тому сили і потенціальна енергія міжмолекулярної взаємодії достатньо великі. Для молекул рідини середня кінетична енергія теплового руху kT сумірна з потенціальною енергією парної взаємодії ( 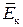

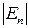 ). За таких умов сума кінетичної та потенціальної енергії конкретної пари молекул може стати від’ємною. Система таких молекул уже не може самовільно розсіюватись в об’ємі та перебуває у зв’язаному стані. Молекули рідини, маючи від’ємну енергію, виконують коливальні рухи навколо тимчасових положень рівноваги. Та оскільки
). За таких умов сума кінетичної та потенціальної енергії конкретної пари молекул може стати від’ємною. Система таких молекул уже не може самовільно розсіюватись в об’ємі та перебуває у зв’язаному стані. Молекули рідини, маючи від’ємну енергію, виконують коливальні рухи навколо тимчасових положень рівноваги. Та оскільки 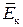

 , то молекули, які мають надлишок кінетичної енергії (
, то молекули, які мають надлишок кінетичної енергії ( 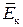 >
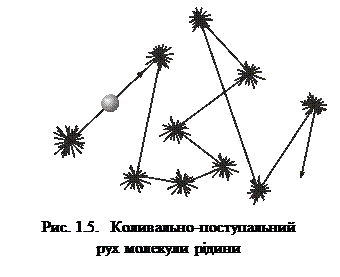
>  ), можуть „перестрибувати” у нове рівноважне положення, виконуючи навколо нього подальші коливальні рухи. Такий стрибкоподібний рух молекул однаково ймовірний у всіх напрямах. Отже, для молекул рідини характерний коливально-поступальний рух (рис. 1.5). Згідно з трактуваннями Я. Френкеля, час „осілого життя” τ, тобто час, протягом якого молекула рідини коливається навколо положення рівноваги,
), можуть „перестрибувати” у нове рівноважне положення, виконуючи навколо нього подальші коливальні рухи. Такий стрибкоподібний рух молекул однаково ймовірний у всіх напрямах. Отже, для молекул рідини характерний коливально-поступальний рух (рис. 1.5). Згідно з трактуваннями Я. Френкеля, час „осілого життя” τ, тобто час, протягом якого молекула рідини коливається навколо положення рівноваги,
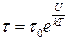 , (1.12)
, (1.12)
 де
де 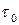 – період коливань молекули; U – висота потенціального бар’єра; T – абсолютна темпера-тура.
– період коливань молекули; U – висота потенціального бар’єра; T – абсолютна темпера-тура.
За висоту потенціального бар’єра U приймають мінімальну енергію, яку потрібно надати молекулі для „перестрибування” з одного положення рівноваги в інше. Зокрема, за кімнатної температури для молекул води 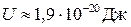 , а
, а 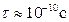 . Від часу „осілого життя” залежать такі властивості рідин, як в’язкість та дифузія.
. Від часу „осілого життя” залежать такі властивості рідин, як в’язкість та дифузія.
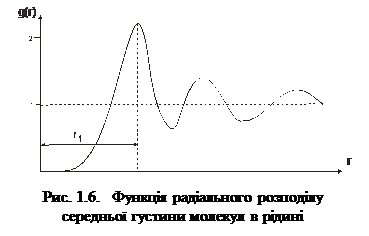 На відміну від газів, для рідин характерна певна впорядкованість у розташуванні молекул ближнього оточення. Тому рідини мають певну внутрішню структуру, яку називають ближнім порядком рідини. Рентгено-структурні дослідження рідин, уперше виконані 1916 р. П. Дебаєм і П. Шерером, підтвердили той факт, що молекули рідин в околі молекули, вибраної за центральну, справді розміщені в певному порядку й утворюють структуру. Кількісною характе-ристикою впорядкованої струк-тури у рентгенографії є так звана функція радіального роз-поділу g(r), яка описує розподіл середньої густини молекул уздовж довільно обраного ра-діуса-вектора r. Функція ра-діального розподілу має вигляд
На відміну від газів, для рідин характерна певна впорядкованість у розташуванні молекул ближнього оточення. Тому рідини мають певну внутрішню структуру, яку називають ближнім порядком рідини. Рентгено-структурні дослідження рідин, уперше виконані 1916 р. П. Дебаєм і П. Шерером, підтвердили той факт, що молекули рідин в околі молекули, вибраної за центральну, справді розміщені в певному порядку й утворюють структуру. Кількісною характе-ристикою впорядкованої струк-тури у рентгенографії є так звана функція радіального роз-поділу g(r), яка описує розподіл середньої густини молекул уздовж довільно обраного ра-діуса-вектора r. Функція ра-діального розподілу має вигляд
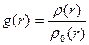 , (1.13)
, (1.13)
 де
де  – середня густина молекул у сферичному шарі радіуса r товщини dr;
– середня густина молекул у сферичному шарі радіуса r товщини dr; 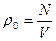 – середня густина молекул за умови рівно-мірного розподілу по об’єму V. На рис. 1.6 показана експериментальна залежність g(r), характерна для рідин. Як бачимо, функція g(r) має кілька максимумів, осцилюючи відносно одиниці. Максимуми на графіку відповідають найімовірні-шим відстаням між молекулами рідини. На практиці в рентгенографії рідин частіше використовують функцію
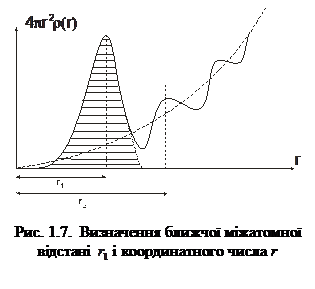
– середня густина молекул за умови рівно-мірного розподілу по об’єму V. На рис. 1.6 показана експериментальна залежність g(r), характерна для рідин. Як бачимо, функція g(r) має кілька максимумів, осцилюючи відносно одиниці. Максимуми на графіку відповідають найімовірні-шим відстаням між молекулами рідини. На практиці в рентгенографії рідин частіше використовують функцію 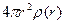 , графік якої зображено на рис. 1.7. За цим графіком визначають кількісні параметри ближнього порядку рідини, зокрема, найближчу міжатомну відстань r1 і координаційне число Z1. Координаційному числу Z1 (кількості атомів у першій координаційній сфері) відповідає площа під першим максимумом, а найближчій міжатомній відстані r1 – відстань від початку координат до першого максимуму.
, графік якої зображено на рис. 1.7. За цим графіком визначають кількісні параметри ближнього порядку рідини, зокрема, найближчу міжатомну відстань r1 і координаційне число Z1. Координаційному числу Z1 (кількості атомів у першій координаційній сфері) відповідає площа під першим максимумом, а найближчій міжатомній відстані r1 – відстань від початку координат до першого максимуму.
Сучасна наука розглядає рідину як систему, що має структуру ближнього порядку і складається з багатьох молекул, що рухаються коливально-поступально і взаємодіють між собою. Фізичні властивості і структура рідин суттєво залежать від характеру міжмолекулярних зв’язків та хімічного складу рідини.
Дата добавления: 2015-09-02; просмотров: 1228;
