Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
У молекулярно-кінетичній теорії (МКТ), як звичайно, користуються ідеалізованою моделлю газу – ідеальним газом. Газ уважатимемо ідеальним, якщо: а) власним об’ємом його молекул можна знехтувати, тобто вважати молекули матеріальними точками; б) сили взаємодії між молекулами газу на відстані не діють, молекули абсолютно пружно взаємодіють лише під час зіткнень.
 Стан ідеального газу заданої маси описують трьома параметрами: р – тиск, V – об’єм і Т – абсолютна температура (Т=273, 15 + t°C). За умови зміни параметрів газу говорять про процес переходу газу з одного стану в інший. Ще до створення МКТ експеримен-тально були виведені три газові закони для ізотермічного, ізобарного та ізохорного процесів.
Стан ідеального газу заданої маси описують трьома параметрами: р – тиск, V – об’єм і Т – абсолютна температура (Т=273, 15 + t°C). За умови зміни параметрів газу говорять про процес переходу газу з одного стану в інший. Ще до створення МКТ експеримен-тально були виведені три газові закони для ізотермічного, ізобарного та ізохорного процесів.
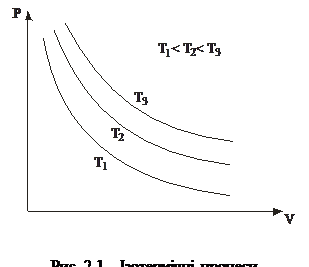
1. Ізотермічний процес – це процес, який відбувається з газом за сталої температури. Його описує закон Бойля–Маріотта: для заданої маси газу за сталої температури добуток тиску газу на його об’єм є сталою величиною:
pV=const, (T= const, m= const). (2.1)
У координатах pV графік процесу показаний гіперболою (рис. 2.1).
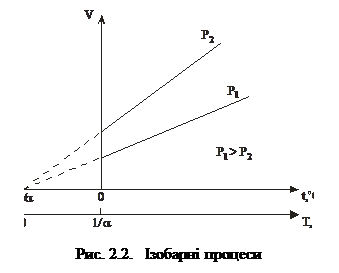 2. Ізобарний процес – це процес, який відбувається з газом за сталого тиску. Його описує закон Гей–Люссака: об’єм заданої маси газу за сталого тиску залежить від температури лінійно:
2. Ізобарний процес – це процес, який відбувається з газом за сталого тиску. Його описує закон Гей–Люссака: об’єм заданої маси газу за сталого тиску залежить від температури лінійно:
V=V0(1+at°C), (2.2)
(р=const, m=const). (2.2)
Тут коефіцієнт a=1/273,15 К-1, V0 – об’єм газу за температури t=0оС. Якщо у (2.2) ввести абсолютну температуру Т, то рівняння ізобарного процесу набуде вигляду
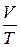 =const. (2.3)
=const. (2.3)
Графіки процесів у координатах V t і VT зображені на рис. 2.2.
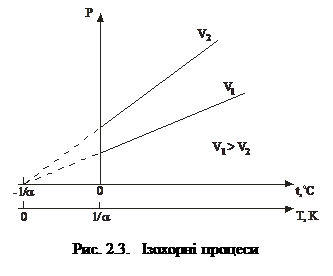 3. Ізохорний процес – це процес, який відбувається з газом за сталого об’єму. Його описує закон Шарля: тиск заданої маси газу за сталого об’єму залежить від температури лінійно:
3. Ізохорний процес – це процес, який відбувається з газом за сталого об’єму. Його описує закон Шарля: тиск заданої маси газу за сталого об’єму залежить від температури лінійно:
р=р0(1+at°C), (2.4)
(V= const, m= const), (2.4)
або 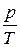 =const (2.5)
=const (2.5)
Графіки ізохорних процесів пока-зані на рис. 2.3.
У загальному випадку незалежно від процесів, які відбуваються з ідеальним газом, його стан описує рівняння Клайперона–Менделєєва:
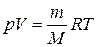 , (2.6)
, (2.6)
де m – маса газу; М – його молярна маса, R – універсальна газова стала. Рівняння (2.6) можна вивести, розглянувши два процеси переходу газу зі стану з параметрами p1, V1, T1 у стан p2, V2, T2 через проміжний стан p2, 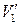 , T1 та скориставшись рівняннями (2.3), (2.5), (2.6).
, T1 та скориставшись рівняннями (2.3), (2.5), (2.6).
Рівняння стану ідеального газу можна записати в іншій формі, врахувавши, що m=N×m0, де N – кількість молекул газу; m0 – маса молекули; молярна маса M=NA×m0, а R=k×NA. Підставимо ці співвідношення у (2.6) і отримаємо:
p=nkT, (2.7)
де n=N/V – концентрація молекул газу.
Отже, за сталої температури тиск газу прямопропорційний до концентрації його молекул.
Дата добавления: 2015-09-02; просмотров: 1958;
