Электрохимические методы
К электрохимическим методам защиты относятся: 1) протекторная защита и 2) электрозащита.
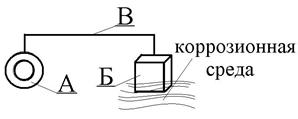
|
| Рис. 8. Схема протекторной защиты |
Протекторная защита (или анодная защита) заключается в использовании так называемого анода-протектора, в качестве которого применяют металл более активный (кадмий, цинк), чем металл защищаемой конструкции (железо, свинец, медь). Протектор Б (рис. 8) соединяют с защищаемой конструкцией А проводником электрического тока В. В процессе коррозии протектор служит анодом, электрохимически окисляется и разрушается, тем самым предохраняя от разрушения защищаемую конструкцию, которая в данной схеме играет роль катода. На поверхности катода идет электрохимический процесс восстановления ионов водорода (в кислой среде) или растворенного в воде кислорода (нейтральная среда).
Протекторная защита может также осуществляться, если металл-протектор использован в виде покрытия (см. далее анодные покрытия) или даже при непосредственном контакте металлов. Например, контакт свинца с более активным цинком способен уменьшить коррозию свинца, происходящую по уравнению:
Pb + 2CH3COOH = (CH3COO)2Pb + H2;
Pb + 2H+ = Pb2+ + H2.
Образовавшиеся ионы свинца легко обнаруживаются при помощи иона I–, образуя с ним яркий золотисто-жёлтый осадок PbI2:
Pb2+ + 2I– = PbI2↓.
Если свинец находится в контакте с цинком, золотисто-жёлтое окрашивание или появляется позже, или совсем отсутствует, что говорит об отсутствии в растворе ионов Pb2+. Сравним стандартные электродные потенциалы цинка и свинца:
Е0Zn2+/Zn0= – 0,762 B, в то время как Е0Pb2+/Pb0= – 0,126 B.
Таким образом, получаем коррозионную гальванопару:
(–) Zn │CH3COOH, KI│Pb (+),
в которой роль анода выполняет цинк как более электроотрицательный металл, окисляющийся при работе гальванопары. На свинцовом катоде происходит процесс восстановления ионов водорода из кислого раствора:
анод: Fe – 2ē = Fe2+ (окисление);
катод: 2H+ + 2ē = H2 (восстановление).
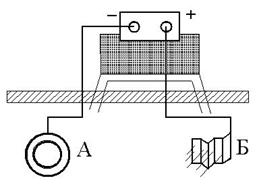
|
| Рис 9. Схема катодной защиты |
Электрозащита (катодная защита) заключается в том, что защищаемая конструкция А (рис. 9) находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженному электроду) внешнего источника электрического напряжения. Защищаемая конструкция становится катодом (принимает отрицательный заряд). В ту жеагрессивную среду помещают кусок (Б) бросового металла (рельс, балка и т.п.), присоединяемый к аноду внешнего источника электричества. В процессе коррозии кусок старого металла становится анодом и разрушается. Катодный метод используют вборьбе с коррозией подземных сооружений. Он имеет существенное преимущество перед протекторной защитой. Так, для последней радиус действия равен приблизительно 50 м, поэтому при необходимости защищать большие поверхности металла требуется целая серия протекторов. Радиус же действия катодной защиты около 2000м.
Дата добавления: 2015-09-14; просмотров: 1050;
