Методы изоляции металла от окружающей среды
Изоляцию защищаемого металла от окружающей среды производят, используя различные покрытия (рис. 10), которые либо наносятся на поверхность металла (металлические и неметаллические), либо образуются при химической обработке поверхности (химические покрытия).
Металлические покрытия слоем более химически стойкого металла являются одним из наиболее распространенных способов защиты металлов от коррозии.
Способы нанесения металлических покрытий. В зависимости от способа получения металлического покрытия различают: 1) гальванические покрытия, 2) горячие покрытия, 3) металлизацию, 4) контактные покрытия.
Получение гальванических покрытий происходит в процессе электролиза. Покрытия получаются наиболее равномерными, что улучшает стойкость против коррозии. Используя гальванические покрытия, можно улучшить декоративные качества изделия.
Издавна известны горячее лужение и цинкование стали. Например, при горячем цинковании стальное изделие погружают в ванну с расплавленным цинком. После охлаждения цинк кристаллизуется на поверхности стального изделия красивыми узорами.
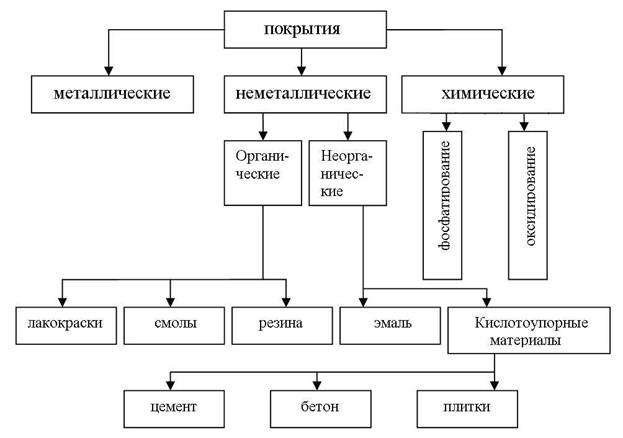
|
| Рис. 10. Защитные покрытия |
Метод металлизации используют с целью экономии металла. Распыление расплавленного металла на защищаемую поверхность производят с помощью струи сжатого воздуха из распыляющего устройства. Этот метод позволяет защищать от коррозии крупногабаритные изделия.
Контактные покрытия получаются в ходе химических реакций в растворе солей на поверхности защищаемого металла,
например:
Fe + CuSО4 = FeSО4 + Cu.
Железо, как более активный металл, восстанавливает ионы меди из раствора. Однако использование этого метода не гарантирует надежной защиты, так как покрытия получаются неплотные, неравномерные.
Анодные и катодные покрытия. Это деление основано на том, как ведут себя металлические покрытия при электрохимической коррозии.
К катодным относятся покрытия, выполненные из тех металлов, электродные потенциалы которых имеют более положительное значение, чем у защищаемого металла, например, медь, никель, серебро. При повреждении покрытия возникает гальванопара, в которой основной материал является анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород. Поэтому катодные покрытия, обеспечивающие хорошую защиту при газовой коррозии, ненадежны в электропроводящих средах, так как повреждение покрытия приводит к усиленной коррозии.
Например, лужение железных изделий заключается в нанесении слоя малоактивного, и потому устойчивого к коррозии олова. При повреждении покрытия образуется гальванопара:
(–) Fe │HCl│Sn (+).
Стандартный электродный потенциал железа Е0 Fe2+/Fe= – 0,44 B, олова Е0 Sn2+/Sn = – 0,136 B. Роль анода в данной коррозионной гальванопаре играет железо как более электроотрицательный (более активный) металл, а роль катода — олово. В процессе работы гальванопары железо окисляется, а на олове (на катоде) в кислой среде происходит восстановление ионов водорода из раствора:
Анод: Fe – 2ē = Fe2+ (окисление);
Катод: 2H+ + 2ē = H2 (восстановление).
Суммарное уравнение: Fe + 2H+ = Fe2+ +H2.
Продукт коррозии: FeCl2.
Чтобы удостовериться в протекании коррозии лужёного железа по указанной схеме, в раствор добавляют гексацианоферрат (III) калия K3[Fe(CN)6]. Это характерный реактив для обнаружения ионов Fe2+, с которыми гексацианоферрат-ион образует окрашенное в темно-синий цвет комплексное соединение (тривиальное название турнбулева синь):
3Fe2+ + 2[Fe(CN)6]3+ = Fe3[Fe(CN)6]2 .
В случае нарушения покрытия в месте повреждения появляется темно-синее окрашивание, свидетельствующее, что в растворе в результате коррозии появляются ионы Fe2+, а значит, коррозии подвергается железо, а не олово.
Анодные покрытия изготавливаются из металлов, Е0 которых имеют более положительное значение, чем у защищаемого металла, например, цинк на железе. В этом случае основной металл является катодом и не корродирует до тех пор, пока не окислится весь цинк. Таким образом, слой цинка работает сначала как изолирующее покрытие, а при повреждении еще и как протектор.
Стандартный электродный потенциал железа Е0 Fe2+/Fe= – 0,44 B, олова Е0 Zn2+/Zn = – 0,76 B. Роль анода выполняет цинк, как более электроотрицательный металл, роль катода — железо.
В кислой среде образуется гальванопара:
(–) Zn │HCl│ Fe (+).
Анод: Zn – 2ē = Zn2+ (окисление);
катод: 2H+ + 2ē = H2 (восстановление).
Суммарное уравнение: Zn + 2H+ = Zn2+ +H2.
Продукт коррозии: ZnCl2.
Неметаллические покрытия могут быть по своей природе как 1) неорганическими, так и 2) органическими. Защитное действие этих покрытий сводится, в основном, к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора, кислотоупорные материалы (цемент, бетон, плитки) и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Химические покрытия получают в ходе процессов фосфатирования и оксидирования (для второго процесса часто используют термин пассивирование) защищаемой поверхности металла.
Перед окрашиванием железных предметов их подвергают фосфатированию — обработке кислыми растворами солей фосфорной кислоты, например дигидрофосфатов железа (II) и марганца (II). В результате окисления железа на его поверхности появляется прочно с ним связанная пористая пленка фосфата железа (III), являющаяся хорошим грунтом для масляных красок.
Оксидирование металлов заключается в создании на поверхности плотных пленок их оксидов, что осуществляется 1) химическим или 2) электрохимическим путем.
В случае химической обработки очищенную от продуктов коррозии и обезжиренную деталь погружают на определенное время враствор окислителя, который вызывает пассивацию металла за счет образования на поверхности металла слоя продуктов окисления (пассивной плёнки)Так, железо пассивируется серной кислотой, если её концентрация превышает 75%. Также, используя способ химического оксидирования, проводят воронение стали, для чего стальной предмет выдерживают в растворе (г/л): 50 NaNO3, 200 NaNO2, NaOH в течение 90 мин. Затем изделие подвергается термической обработке при температуре 140°С.
В случае электрохимической обработки металл помещают в окислительный раствор и для интенсификации его окисления подключают к положительному полюсу (аноду) источника тока. Так, например, получают оксидированный (также используют термин анодированный) алюминий.
Дата добавления: 2015-09-14; просмотров: 1112;
