КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Характерной чертой кристаллического вещества в большинстве случаев является наличие анизотропии, т.е. зависимости физических свойств от направления. В отличие от кристаллов жидкости, газы и аморфные тела являются изотропными. Причиной анизотропии кристаллов является упорядоченное расположение в них атомов или молекул.
Обычно анизотропия не проявляется, т.к. кристаллические тела, как правило, встречаются в виде поликристаллов. Поликристаллы состоят из большого количества маленьких, ориентированных хаотически, монокристаллов. Монокристаллом, строго говоря, называется кристалл, в пределах которого соблюдается абсолютная периодичность в расположении атомов. В реальных кристаллах такой идеальной периодичности быть не может, вследствие различного рода нарушений кристаллической решетки - дефектов. Однако если количество дефектов не слишком велико, то кристалл считается монокристаллом.
Упорядоченность расположения атомов или молекул в кристалле заключаются в том, что они размещаются в узлах геометрически правильной кристаллической решетки. Весь кристалл может быть получен в результате многократного повторения в трех различных направлениях одного и того же структурного элемента, называемого элементарнойкристаллическойячейкой.
Элементарная кристаллическая ячейка представляет собой, в общем случае, косоугольный параллелепипед, построенный на трех векторах: 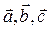 .Модули этих векторов равны периодам идентичности по соответствующим направлениям.
.Модули этих векторов равны периодам идентичности по соответствующим направлениям.
Элементарные ячейки можно выбирать различными способами. Элементарная ячейка, включающая наименьшее число атомов, характеризующих химический состав кристаллического вещества, называется примитивной ячейкой. Однако обычно элементарные ячейки выбирают с большим числом атомов, но так чтобы она обладала такой же симметрией, как и весь кристалл.
Под симметрий кристаллической решетки понимается свойство решетки совпадать с самой собой при некоторых пространственных перемещениях. Всякая решетка обладает, прежде всего, трансляционной симметрией, т. е. совпадает с собой при перемещении на период идентичности в соответствующем направлении.
Рассматривают также симметрию относительно поворотов вокруг некоторых осей и зеркальных отражений относительно плоскостей.
По форме элементарной ячейки кристаллы делят на семь кристаллографических систем. В порядке возрастания симметрии: моноклинная, триклинная, ромбическая, тетрагональная, ромбоэдрическая, гексагональная, кубическая.
В зависимости от природы частиц и характера сил взаимодействия между ними различают четыре физических типа кристаллических решеток: ионные, атомные, металлические, молекулярные.
В ионных кристаллах в узлах решетки расположены ионы, которые взаимодействуют посредством электростатических сил. Весь кристалл с ионной связью между атомами можно рассматривать как огромную молекулу.
В атомных кристаллах в узлах помещаются нейтральные атомы, между которыми существуют гомеополярные (ковалентные) связи. Эти связи образуются валентными электронами и имеют направленный характер, так что каждый атом связан с несколькими ближайшими, количество которых равно количеству валентных электронов.
В металлических кристаллах в узлах располагаются положительные ионы, которые погружены в газ почти свободных электронов.
В молекулярных кристаллах в узлах находятся молекулы, а силы взаимодействия имеют ту же природу, что и силы притяжения молекул в ван-дер-ваальсовском газе.
Каждый атом, находящийся в узле кристаллической решетки обладает тремя колебательными степенями свободы. Соответственно внутренняя энергия моля кристаллического вещества.
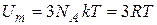 (11.1)
(11.1)
Тогда теплоемкость кристалла
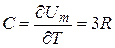 (11.2)
(11.2)
Соотношение (11.2) хорошо выполняется для кристаллов химически простых веществ, при достаточно высоких температурах. Это соотношение было экспериментально установлено Дюлонгом и Птии носит название закона их имени. При низких температурах этот закон не выполняется, но объяснение такого поведения может быть дано только на основе квантовомеханических представлений.
Дата добавления: 2015-09-14; просмотров: 989;
