Агрегатные состояния вещества. Почти все вещества могут находиться в трех агрегатных состояниях ¾ газообразном, жидком и твердом
Почти все вещества могут находиться в трех агрегатных состояниях ¾ газообразном, жидком и твердом. Определяющей данное разделение величиной обычно является отношение a средней потенциальной энергии взаимодействия молекул к их среднекинетической энергии: для газов a << 1, для жидкости a » 1 и для твердых тел a >> 1. В результате больших расстояний между молекулами в газах и, как следствие, слабых сил межмолекулярного взаимодействия (многокомпонентные силы электрической природы, характеризующие притяжение и отталкивание молекул), молекулы движутся в них почти свободно, заполняя весь объем.
В жидкостях межмолекулярное взаимодействие сказывается более сильно, поэтому тепловое движение молекул (атомов) проявляется в их малых колебаниях около положения равновесия и частых перескоках из одного положения в другое. Таким образом, жидкость имеет только ближний порядок в расположении частиц и характерную текучесть.
Основные виды твердого состояния вещества ¾ аморфное и кристаллическое. Аморфное состояние (стекло), как и жидкость, имеет согласованность в расположении ближайших частиц, но малую вероятность их перескоков (по сути переохлажденная жидкость с повышенной вязкостью). В кристаллах атомы совершают только колебания вблизи узлов трехмерной кристаллической решетки, при этом их структура имеет высокую степень упорядоченности. Порядок, свойственный расположению атомов в кристалле, часто приводит к симметрии его наружной формы. В кристаллической структуре выделяют мельчайшие «строительные блоки» (элементарные ячейки), путем переноса которых в трех направлениях (трансляции) можно построить весь кристалл. Элементарные ячейки разнообразны: простая кубическая решетка (рис. 5.1), объемно-центрированная кубическая структура и т. д.
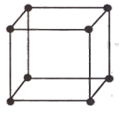
Рис. 5.1
В кристаллах возможен полиморфизм: способность некоторых веществ существовать в состояниях с различной кристаллической структурой. Например, углерод может иметь структуру алмаза (сочетание двух гранецентрированных кубических подрешеток, вставленных друг в друга) и гексагональную структуру (графит). В 1985 году в университете Райса обнаружена возможность атомов углерода соединяться в оболочки с 60 гранями (напоминают футбольный мяч). За открытие и исследование «нового углерода», обладающего уникальными свойствами, ученым Г. Крото, Р. Смолли и Р. Керлу присуждена Нобелевская премия 1996 года.
Встречаются и кристаллические решетки, состоящие из молекул, удерживаемых слабыми межмолекулярными силами (лед, твердые простые вещества, образованные многоатомными молекулами, кристаллы многих полимеров, например, белков и нуклеиновых кислот и т. д.). Кристаллы с подобными решетками назвали молекулярными.
Особым состоянием некоторых органических веществ являются жидкие кристаллы, которые обладают свойством жидкости ¾ текучестью, но сохраняют определенную упорядоченность в расположении молекул и анизотропию ряда свойств.
Четвертым агрегатным состоянием вещества часто считают плазму, представляющую собой газ заряженных частиц (ионов, электронов и т. д.), которые электрически взаимодействуют друг с другом на больших расстояниях. В чистом виде ее можно получить при нагреве газа до колоссальной температуры Т = 106 К. Плазма является наиболее распространенным состоянием вещества во Вселенной.
Дата добавления: 2015-10-19; просмотров: 2193;
