Агрегатные состояния вещества
Как известно, любое вещество может находиться в твёрдом, жидком и газообразном состоянии. Это зависит от температуры, давления, а также от того, как сильно взаимодействуют частицы вещества. Выражаясь точнее, реализация того или иного агрегатного состояния вещества определяется соотношением средней энергии движения его атомов или молекул (Екин) и средней энергии их взаимодействия (Епот). Если Екин >> Епот , вещество находиться в газообразном состоянии. При этом частицы вещества располагаются на относительно больших расстояниях друг от друга и практически не взаимодействуют, за исключением случайных столкновений, в которых они разлетаются подобно биллиардным шарам. Двигаясь почти свободно, частицы газа занимают весь предоставленный им объём, и этим объясняется самое общее свойство всех газов – их летучесть.
С понижением температуры уменьшается энергия движения частиц вещества, и всё заметнее начинают проявляться силы межатомного или межмолекулярного взаимодействия. Частицы при случайном столкновении уже не отскакивают друг от друга подобно биллиардным шарам, а как бы «прилипают» друг к другу. Это приводит к переходу вещества в более плотное, конденсированное состояние – сначала в жидкое, а затем и в твёрдое.
В жидком состоянии энергия движения частиц вещества сравнима с энергией их взаимодействия (Екин @ Епот). В результате связи между частицами оказываются неустойчивыми, легко нарушаемыми тепловым движением. Частицы часто меняют своих ближайших соседей, совершая так называемые перескоки с места на место, чем и объясняется текучесть жидкостей.
В твёрдом состоянии средняя энергия движения частиц вещества не превышает энергию межатомных или межмолекулярных связей (Екин < Епот). Перескоки частиц совершаются крайне редко, и вещество длительное время сохраняет свою форму, т.е. остаётся твёрдым.
С изменением температуры или давления изменяется соотношение между энергией движения частиц вещества и энергией их взаимодействия. Повышение температуры приводит к возрастанию Екин , а повышение давления – к возрастанию Епот , и наоборот. Следствием изменения соотношения энергий является переход вещества из одного агрегатного состояния в другое.
Как показывает опыт, чаще на практике находят применение материалы, находящиеся в твёрдом состоянии.
1.2 Аморфное и кристаллическое состояние твёрдых тел
Вещества, находящиеся в твёрдом состоянии, могут быть либо аморфными, либо кристаллическими. Аморфное состояние твёрдых тел характеризуется тем, что атомы, молекулы или ионы вещества располагаются в пространстве хаотически. Аналогичную внутреннюю структуру имеют жидкости, но в них частицы вещества за счёт энергии теплового движения совершают частые перескоки с места на место, что и является причиной текучести жидкостей. В аморфных материалах более сильное взаимодействие удерживает частицы вещества вместе и не позволяет им совершать частые перескоки с места на место. В результате образец остаётся твёрдым и не течёт, хотя и имеет структуру жидкости. Учитывая вышесказанное, аморфное состояние обычно отождествляют с переохлаждённой жидкостью, у которой бесконечно высокая вязкость. С повышением температуры вязкость этой «твёрдой жидкости» плавно понижается, вещество размягчается и постепенно переходит из твёрдого состояния в жидкое. Примером материала, находящегося в аморфном состоянии, является обычное оконное стекло, а также янтарь – окаменевшая смола древних деревьев.
Кристаллические материалы переходят в жидкое состояние при постоянной температуре, называемой температурой плавления. Обратный переход осуществляется также при постоянной температуре, называемой температурой кристаллизации.
В кристаллических твёрдых телах частицы вещества располагаются в пространстве упорядоченно, т.е. выстроены правильными рядами, плоскостями, симметричными блоками, что придаёт отдельным кристаллам (монокристаллам) характерную правильную огранку. Кристаллическое состояние твёрдых тел встречается в природе чаще, чем аморфное, поскольку обладает меньшей свободной энергией и, в силу этого, является более стабильным. С течением времени многие аморфные тела стремятся перейти в кристаллическое состояние. Примерами кристаллических материалов являются различные горные минералы (кварц, гранит, рубин, алмаз и т.д.), а также соль, речной песок и глина, состоящая в основном из мелких кристаллов Al2O3. Металлы и сплавы также являются кристаллическими материалами. Однако они, в отличие от монокристаллов, имеют поликристаллическое строение, т.е. состоят из множества микроскопических кристалликов неправильной формы (зёрен), случайным образом ориентированных в пространстве.
Необходимо отметить, что одно и то же вещество может быть получено как в кристаллическом, так и в аморфном состоянии. Например, в металлах и сплавах при их сверхбыстром охлаждении из жидкого или газообразного состояний не успевает сформироваться упорядоченная кристаллическая структура и образуется аморфное твёрдое тело (metal glass - металлическое стекло). При этом свойства аморфного металла могут заметно отличаться от свойств кристаллического образца, что свидетельствует о важности внутренней атомной структуры материала в формировании его свойств. Аморфное состояние металлов чаще всего оказывается крайне нестабильным при комнатной температуре. С течением времени наблюдается переход из такого состояния в более стабильное кристаллическое состояние и этот процесс ускоряется с повышением температуры. В тоже время путём подбора химического состава металлических материалов их аморфное состояние иногда удаётся застабилизировать. Примером может служить металлическое стекло Fe80B20, аморфное состояние которого является достаточно стабильным при комнатной и более высоких температурах.
1.3 Понятие кристаллической решётки
Для описания упорядоченного расположения частиц вещества в кристаллах используют некую геометрическую модель, называемую кристаллической решёткой. Кристаллическая решётка представляет собой воображаемую пространственную координатную сетку, узлы которой показывают расположение в пространстве центров тяжести атомов, молекул или ионов кристалла. Поскольку частицы в кристаллах располагаются закономерно, нет необходимости изображать всю пространственную сетку, достаточно ограничиться изображением системы координат и минимальной группы повторяющихся в ней узлов. Такую минимальную группу узлов, периодически повторяющихся в пространстве, называют элементарной ячейкой. В общем случае элементарная ячейка имеет вид параллелепипеда, частным случаем которого является куб (рис. 1).
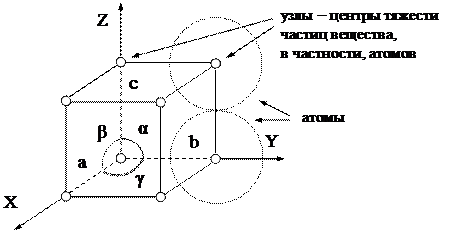
Рис. 1. Простая кубическая элементарная ячейка.
Рёбра элементарного параллелепипеда (a, b, c) и его углы (α, β, γ) называют параметрами элементарной ячейки. Соотношения между этими параметрами определяют форму элементарной ячейки и соответствующую систему симметрии. Всего существует 7 систем симметрии:
1) триклинная a ≠ b ≠ c, α ≠ β ≠ γ ≠ 90°;
2) моноклинная a ≠ b ≠ c, α = β = 90°, γ ≠ 90°;
3) ромбическая a ≠ b ≠ c, α = β = γ = 90°;
4) ромбоэдрическая a = b = c, α = β = γ ≠ 90°;
5) гексагональная a = b ≠ c, α = β = 90°, γ = 120°;
6) тетрагональная a = b ≠ c, α = β = γ = 90°;
7) кубическая a = b = c, α = β = γ = 90°.
Если элементарную ячейку перемещать (транслировать) вдоль координатных осей OX, OY и OZ с шагом, соответственно a, b и c, то можно воспроизвести всю пространственную координатную сетку, т.е. кристаллическую решётку. Параметры элементарной ячейки a, b и c называют также периодами кристаллической решётки. По своему физическому смыслу это расстояния между центрами тяжести соседних частиц, в частности атомов, сближенных в кристаллах до соприкосновения. По порядку величины a, b и c составляют 0,1 нанометра (1нм это 10-9м), или 1 Ангстрем (1Å = 10-10 м).
Элементарная ячейка, изображённая на рис. 1, относится к числу простых (примитивных) ячеек. Но возможны и более сложные ячейки, содержащие дополнительные узлы, расположенные либо в центре всех граней элементарного параллелепипеда (гранецентрированная ячейка), либо в центре верхней и нижней грани (базоцентрированная ячейка), либо в центре объёма (объёмоцентрированная ячейка). Всего насчитывается 14 типов элементарных ячеек (трансляционных решёток Бравэ), которые неравномерно распределены по 7 системам симметрии. В частности, триклинной системе симметрии принадлежит только одна примитивная ячейка, а кубическая система симметрии содержит примитивную, объёмоцентрированную и гранецентрированную ячейки.
Дата добавления: 2015-10-19; просмотров: 2197;
