Примеры решения задач. Пример 29.1.Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пример 29.1.Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С2Н4 → Х → Y → С2Н5−О−С2Н5
Указать условия протекания реакций. Назвать вещества Х и Y.
Решение. Конечный продукт – диэтиловый эфир – получается из этилового спирта, следовательно, вещество Y – этанол. Перейти от этилена к этанолу можно через промежуточное соединение – галогенопроизводное этана (вещество Х).
1. При взаимодействии этилена с бромоводородом образуется бромэтан:
C2H4 + HBr → C2H5Br
2. Бромэтан гидролизуется до спирта действием водного раствора NaOH:
C2H5Br + NaOH → C2H5OH + NaBr
3. При нагревании этанола до 140 оС в присутствии серной кислоты в качестве катализатора образуется диэтиловый эфир:
C2H5OH 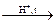 С2Н5−О−С2Н5 + H2O
С2Н5−О−С2Н5 + H2O
Пример 29.2. Какая масса пропилата натрия может быть получена при взаимодействии 15 г пропанола-1 с 9,2 г натрия?
Решение. Записываем уравнение реакции между пропанолом-1 и металлическим натрием:
2CH3−СH2−СН2−OH + 2Na → 2CH3−СH2−СН2−ONa + H2
Определяем количества вещества пропанола-1 и натрия:
υ(С3Н7ОН) = 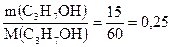 моль;
моль;
υ(Na) = 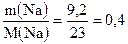 моль.
моль.
Из уравнения реакции следует, что число моль спирта и натрия должны быть равны, следовательно, натрий взят в избытке.
На основании уравнения реакции записываем:
υ(C3H7ONa) = υ(C3H7OH); υ(C3H7ONa) = 0,25 моль.
Определяем массу пропилата натрия, которую можно получить:
m(C3H7ONa) = υ(C3H7ONa) ∙ M(C3H7ONa);
m(C3H7ONa) = 0,25 ∙ 82 = 20,5 г
Пример 29.3. Формалин представляет собой 40 %-ный водный раствор формальдегида. Рассчитать массу метанола, которую необходимо окислить для получения 600 г формалина.
Решение. 1. Вычисляем массу формальдегида, который потребуется для приготовления формалина:
M(CH2O) = 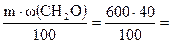 240 г.
240 г.
2. Количество вещества требуемого формальдегида равно:
υ(CH2O) = 
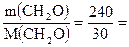 8 моль.
8 моль.
3. Составляем уравнение реакции окисления метанола:
CH3OH + [O] → CH2O + H2O
Из уравнения реакции следует, что
υ(CH3OH) = υ(CH2O); υ(CH2O) = 8 моль.
4. Масса требуемого метанола равна:
m(CH3OH) = υ(CH3OH) ∙ M(CH3OH);
m(CH3OH) = 8 ∙ 32 = 256 г.
Задачи
№ 29.1. При взаимодействии бутанола-1 с избытком металлического натрия выделилось 2,8 л водорода при нормальных условиях. Определить количество вещества С4Н9ОН, которое вступило в реакцию. (Ответ: 0,25 моль).
№ 29.2. Назвать вещества Х и Y и написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) пропанол-1 → Х → пропанол-2
б) этанол → Y → 1,2-дихлорэтан
Указать условия протекания реакций.
№ 29.3. Для получения метанола использовали 2 м3 оксида углерода (II) и 5 м3 водорода (условия нормальные). Получено 2,04 кг спирта. Определить выход спирта. (Ответ: 71,4 %).
№ 29.4. При помощи каких реакций можно осуществить следующий цикл превращений:
С → СН4 → С2Н6 → С2Н4 → С2Н5ОН → С2Н5ОNa
№ 29.5.Определить массу фенолята натрия, который может быть получен при взаимодействии 4,7 г фенола с 4,97 мл 35 %-ного раствора NaОН
(ρ = 1,38 г/мл). (Ответ: 5,8 г).
№ 29.6.Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорэтан → этанол → этилен → пропаналь
№ 29.7.При окислении 13,8 г этанола избытком оксида меди (II) получен альдегид, масса которого составила 9,24 г. Определить выход продукта реакции. (Ответ: 70 %).
№ 29.8.Определить массу серебра, которое будет получено, если к избытку аммиачного раствора оксида серебра прибавить 50 г 11,6 %-ного водного раствора пропаналя. (Ответ: 21,6 г).
№ 29.9.Какое количество вещества НСНО содержится в его 30 %-ном водном растворе объемом 3 л и плотностью 1,06 г/мл?
(Ответ: 31,8 моль).
№ 29.10. 280 мл ацетилена было использовано для получения ацетальдегида, выход которого составил 80 %. Какая масса серебра может образоваться при добавлении всего полученного альдегида к избытку аммиачного раствора оксида серебра? (Ответ: 1,08 г).
№ 29.11. При помощи каких реакций можно осуществить следующие превращения:
С → СаС2 → С2Н2 → С2Н4 → С2Н6 → С2Н5Cl → С2Н5ОН
№ 29.12.При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра образовалось 20 г металла. Определить массовую долю (%) этаналя в техническом препарате. (Ответ: 67,9 %).
№ 29.13. При помощи каких реакций можно осуществить следующие превращения: метан → ацетилен → уксусный альдегид → этиловый спирт
→ уксусный альдегид
№ 29.14.При помощи каких реакций можно осуществить следующие превращения:
С → СН4 → С2Н2 → С6Н6 → С6Н5Cl → С6Н5ОН
№ 29.15.Рассчитать массу фенолята калия, который может быть получен из 3,29 г фенола. (Ответ: 4,62 г).
№ 29.16.Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
уксусный альдегид → этанол → этилен → ацетилен → уксусный альдегид
№ 29.17.Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
а) СН4 → Х → СН3ОН → СН3−О−СН3
б) этанол → этилен → Y → этанол
Назвать вещества Х и Y.
№ 29.18.При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2 %. Определить массу пропанола-2, взятого для реакции. (Ответ: 2,4 г).
№ 29.19.Рассчитать массу фенола, который можно получить гидролизом бромбензола массой 47,1 г, если массовая доля выхода продукта равна 40 %. (Ответ: 11,28 г).
№ 29.20.Составить уравнения реакций, которые необходимо провести для осуществления следующих превращений: пропин → Х → ацетон.
Назвать вещество Х, указать условия протекания реакций.
Дата добавления: 2015-09-11; просмотров: 3577;
