Теоретическое введение. Коррозией называется самопроизвольное разрушение металлов под воздействием окружающей среды
Коррозией называется самопроизвольное разрушение металлов под воздействием окружающей среды. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химической коррозией называется окисление металла, не сопровождающееся возникновением в системе электрического тока. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и жидкими неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса:
анодный – окисление металла:
М – nē → Mn+ ,
катодный – восстановление окислителя:
Ox + nē → Red.
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы O2 воздуха и ионы H+ электролита. Восстановление на катоде молекул О2 и ионов Н+ протекает по уравнениям:
O2 + 2H2O + 4 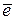 = 4OH‾ − в щелочной или нейтральной среде,
= 4OH‾ − в щелочной или нейтральной среде,
2H+ + 2 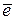 = H2 − в кислой среде.
= H2 − в кислой среде.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности образуется большое количество непрерывно действующих микрогальванических элементов. Разрушается более активный металл. Например, при контакте железа с медью в присутствии электролита – соляной кислоты – возникает гальванический элемент
(анод) (−) Fe | HCl | Cu (+) (катод)
и происходит электрохимическая коррозия.
На аноде идет процесс окисления: Fe0 − 2ē = Fe2+
На катоде – процесс восстановления: 2H+ + 2ē = H2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
При контакте железа с медью во влажном воздухе образуется гальванический элемент (−) Fe | H2O, О2 | Cu (+) и процесс коррозии выражается уравнениями:
на аноде: Fe0 − 2ē = Fe2+
на катоде: O2 + 2H2O + 4ē = 4OH‾
 |
2Fe + O2 + 2H2O = 2Fe(OH)2
Под влиянием кислорода воздуха гидроксид железа (II) окисляется по уравнению: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Далее Fe(OH)3 частично теряет воду и превращается в ржавчину.
Одним из важнейших методов защиты металлов от коррозии являются защитные покрытия металлов, которые изолируют металл от внешней среды и могут быть неметаллическими (лаки, краски, эмали) и металлическими. Различают катодные и анодные металлические покрытия. Покрытие защищаемого металла менее активным металлом называется катодным, например, луженое железо. Покрытие защищаемого металла более активным называется анодным, например, оцинкованное железо. В случае нарушения целостности покрытий и наличия раствора электролита разрушается более активный металл. Так, в случае хромированного железа (анодное покрытие) будет разрушаться хром:
(−) Cr | HCl | Fe (+)
на аноде: Cr0 − 3ē = Cr3+
на катоде: 2H+ + 2ē = H2
В случае никелированного железа (катодное покрытие) разрушается железо:
(−) Fe | HCl | |Ni (+)
на аноде: Fe0 − 2ē = Fe2+
на катоде: 2H+ + 2ē = H2
Дата добавления: 2015-09-11; просмотров: 960;
