Общие химические превращения карбоновых кислот связаны с проявлением кислотных свойств.
1. Диссоциация:
RCOOH + H2O «RCOO- + H3O+
Карбоновые кислоты изменяют окраску индикаторов (лакмуса, метилового оранжевого в красный цвет).
2.Взаимодействие с активными металлами:
2RCOOH + Mg ® (RCOO)2Mg + H2
3. Реакция нейтрализации:
RCOOH + OH- ® RCOO- + H2O
Натриевые и калиевые соли карбоновых кислот имеют ионный характер, растворяются в воде и нерастворимы в органических растворителях. Это обстоятельство можно использовать для перевода кислоты из раствора в органическом растворителе, не смешивающемся с водой, в водную фазу.
4. Взаимодействие с оксидами металлов:
СаО + 2RCOOH ® (RCOO)2Ca + H2O
5. Обменные реакции – вытеснение солей более слабых кислот:
Na2CO3 + 2RCOOH ® 2RCOONa + CO2 + H2O
6. Реакции ОН-группы: этерификация, образование ангидридов и хлорангидридов:
|
|
|
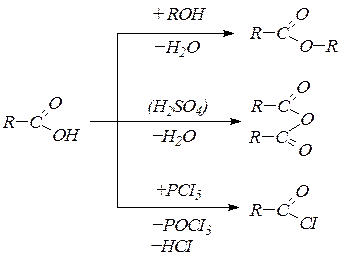
7. Реакции, характерные для карбонильной группы, затруднены. Гидрирование можно осуществить в очень жестких условиях. Карбоновые кислоты устойчивы по отношению к окислителям и восстановителям. Специфические свойства проявляет в этом отношении муравьиная кислота, вступающая в реакцию” серебряного” и “медного” зеркала.
8. Реакции углеводородного радикала:
а) для предельных одноосновных кислот – образование a-галогензамещенных кислот
R-CH2-COOH + Br2 ® R-CHBr –COOH + HBr
б) для непредельных кислот – реакции присоединения, окисления и полимеризации. Присоединение галогеноводородов к ненасыщенным кислотам с сопряженными двойными связями (a-, b-ненасыщенные кислоты) идет против правила Марковникова:
СН2=СН-СООН + НBr ® СН2Br –CH2-СООН
Карбоксильная группа стабильна к повышению температуры и отщепляет диоксид углерода лишь в исключительных случаях, например, у некоторых соответствующим образом замещенных кислот и некоторых дикарбоновых кислот. Такая реакция называется декарбоксилированием.
Дата добавления: 2015-09-11; просмотров: 1018;
