Окислювально – відновні процеси.
Усі хімічні реакції можна розділити на дві групи:
ü ступені окиснення елементів залишаються незмінними (реакції обміну, гідролізу, дисоціації, тощо);
ü супроводжуються зміною ступенів окиснення елементів (окисно – відновні реакції).
Процеси окиснення та відновлення споріднені між собою. Коли одна речовина віддає електрони і окиснюється, то обов’язково має бути інша, яка приєднує електрони і відновлюється. Обидва процеси відбуваються сумісно.
Окисники – частинки, які приєднують електрони. Процес приєднання електронів – відновлення.
Відновники – частинки, які віддають електрони. Процес віддавання електронів – окиснення.

Явища окиснення – відновлення загалом можна розглядати як перенесення електронів від відновника до окисника. У кожній реакції число електронів, відданих відновником, дорівнює числу електронів, приєднаних окисником.
Для кількісної характеристики окисної та відновної здатності речовин використовують електродні потенціали.
 - перехід металу в розчин, окиснення.
- перехід металу в розчин, окиснення.
 - осадження металу, відновлення
- осадження металу, відновлення  .
.

Якщо метал 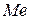 занурити у воду, то полярні молекули води внаслідок гідратації поверхні спричинятимуть перехід гідратованих іонів металу в розчин. Металічна поверхня набуде негативного заряду, який створюється залишеними на ній електронами. Внаслідок цього виникне електростатичне притягання між іонами (+), які перейшли в розчин, і поверхнею металу (-). Це перешкоджає подальшому розчиненню металу і виникає зворотній процес – відновлення іонів металу на поверхні до вільного металу:
занурити у воду, то полярні молекули води внаслідок гідратації поверхні спричинятимуть перехід гідратованих іонів металу в розчин. Металічна поверхня набуде негативного заряду, який створюється залишеними на ній електронами. Внаслідок цього виникне електростатичне притягання між іонами (+), які перейшли в розчин, і поверхнею металу (-). Це перешкоджає подальшому розчиненню металу і виникає зворотній процес – відновлення іонів металу на поверхні до вільного металу:
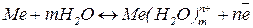
Стан рівноваги залежить від співвідношення між кількістю енергії, потрібної для відщеплення іона від поверхні металу та кількістю енергії, яка виділяється внаслідок гідратації іона.
Частина іонів металу, що перейшли в розчин, не розподіляються по всьому об’єму, а притягуються до протилежно зарядженої поверхні металу і розміщуються біля неї. За рахунок електричних зарядів металу та іонів електроліту з боку розчину на межі метал – розчин утворюється подвійний електричний шар.
Іонні окисно – відновні системи, які реалізуються на металічному провіднику, називають електродами.
Різниця електричних потенціалів між металом і розчином визначає потенціал електрода. В електродному потенціалі закладена окисно – відновна здатність системи.
Заряд поверхні металу в подвійному електричному шарі може бути як негативним, так і позитивним. Негативний заряд поверхні характерний для металів, іони яких мають високу здатність до переходу в розчин. З підвищенням у розчині концентрації іонів металу  , згідно з принципом Ле Ательє, рівновага
, згідно з принципом Ле Ательє, рівновага
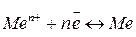
зміщується в бік твердої фази металу. Якщо концентрація іонів  велика, а метал малоактивний, то його іони починають переходити з розчину на поверхню металу. Заряд поверхні металу стає позитивним, а шар розчину, що містить надлишок аніонів, - негативним. Отже, за рахунок зміщення положення електродної рівноваги може змінитися не тільки значення, а й знак потенціалу.
велика, а метал малоактивний, то його іони починають переходити з розчину на поверхню металу. Заряд поверхні металу стає позитивним, а шар розчину, що містить надлишок аніонів, - негативним. Отже, за рахунок зміщення положення електродної рівноваги може змінитися не тільки значення, а й знак потенціалу.
У даному розчиннику електродний потенціал залежить від природи металу, концентрації його іонів у розчині та температурі. Ця залежність описується рівнянням Нернста:

 - стандартний електродний потенціал (потенціал електрода за температури
- стандартний електродний потенціал (потенціал електрода за температури
298 К, тиску газоподібних речовин 101325 Па, концентрації іонів 1 моль/л);
 - універсальна газова стала 8,314 Дж/К моль;
- універсальна газова стала 8,314 Дж/К моль;
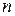 - кількість електронів у напівреакції;
- кількість електронів у напівреакції;
 - стала Фарадея 96500 Кл/моль;
- стала Фарадея 96500 Кл/моль;
 - активна концентрація окисленої форми;
- активна концентрація окисленої форми;
 - активна концентрація відновленої форми.
- активна концентрація відновленої форми.
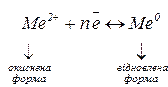
За температури 298 К:

Дата добавления: 2015-09-02; просмотров: 819;
