Рівняння стану. Ізопроцеси. Закон Дальтона
Газ може бути в різних станах, тобто деяка маса газу має об’єм V, тиск p і температуру Т. Величини V, p,Т , що характеризують стан газу, називаються термодинамічними параметрами. Рівняння, що зв’язує параметри стану цього газу ( T V p ) називають рівнянням стану ідеального газу.
Слід зазначати, що задовго до того, як рівняння стану ідеального газу було виведено на основі молекулярно-кінетичних уявлень, закономірності поведінки газів у різних умовах були досить добре дослідженні експериментально. Саме тому рівняння стану ідеального газу можна розглядати як узагальнення експериментальних фактів, що знаходять своє пояснення у молекулярно-кінетичній теорії.
Рівняння Менделєєва–Клапейрона дає змогу визначити один невідомий параметр стану ідеального газу, якщо інші параметри відомі, для газу будь-якого хімічного складу і довільної маси m. Єдина величина у цьому рівнянні, що залежить від виду газу, – це його молярна маса µ.
Якщо врахувати, що густина газу ρ = Vm, то рівняння Менделєєва–Клапейрона матиме вигляд р = µρ RТ.
Процеси, що відбуваються при сталому значенні одного з параметрів стану ( Т, V або p) з певною сталою масою газу, називаються ізопроцесами.
Ізотермічний процес - процес , що відбувається при сталій температурі ( Т= const). За законом Бойля-Маріотта, тиск даної маси газу при сталій температурі обернено пропорційний об’єму газу. Отже,
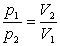 або р1V1=р2V2= const.
або р1V1=р2V2= const.
Криву залежності тиску газу від його об’єму при сталій температурі називають ізотермою.
Графік залежності між параметрами газу при Т = const
Ізобаричний процес – процес, який відбувається при сталому тиску ( р=const).
Виходячи із закону Гей-Люссака, відносна зміна об’єму даної маси газу в ізобарному процесі прямо-пропорційна зміні температури t.
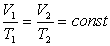
Криву залежності об’єму газу від температури при сталому тиску називають ізобарою.
Графік залежності між параметрами при р= const
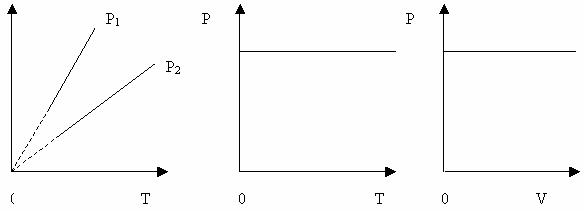
Вищому тиску відповідає нижча ізобара. Штрихи означають, що закон Гей-Люссака в області низьких температур не застосовується. Об’єм не може перетворитися в нуль при температурі – 273 0С.
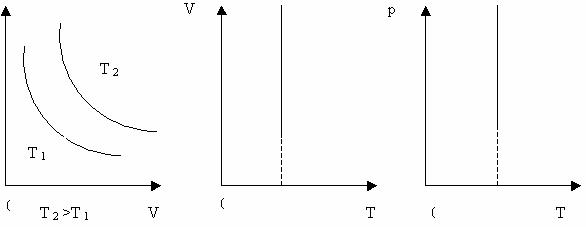
Ізохоричний процес – це процес , який відбувається при сталому об’ємі (V = const). Виходячи із закону Шарля, тиск даної маси газу при сталому об’ємі пропорційний його абсолютній температурі: 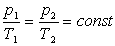
Залежність тиску газу від температури при сталому об’ємі графічно зображається прямою, яка називається ізохорою.Меншому об’ємі відповідає ізохора , що лежить вище.
Графік залежності між параметрами при сталому об’ємі V = const
Р 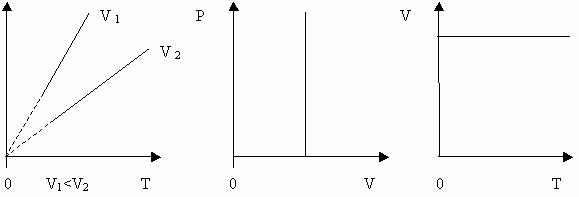
Змінюючи всі три параметра р, V і Т газу і користуючись газовими законами можна отримати рівняння Клапейрона.
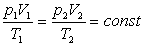
Добуток тиску даної маси газу на об’єм, поділений на абсолютну температуру, є величиною сталою.
При t = 00C, р = 1,013 105Па один моль будь-якого газу має об’єм V0=22,4 10-3м3. Підставивши ці дані в закон Клапейрона, отримуємо значення константи, яка є однакова для будь-якого 1 моля газу. Її називають молярною універсальною газовою сталою.
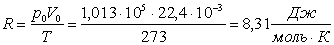
Для будь-якої маси газу рівняння Менделєєва – Клапейрона матиме вигляд:
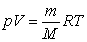
Якщо в об’ємі V знаходиться суміш газів, які не реагують один з одним, то використавши рівняння Менделєєва – Клапейрона, визначимо тиск:
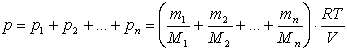
де ті, Мі – маса і молярна маса і – го газу. Закон Дж. Дальтона:
«Тиск суміші газів дорівнює сумі парціальних тисків газів, з яких складається дана суміш».
Парціальним тиском називається тиск, який був би створений за даних умов (Т,V) окремо одним газом з суміші.
Дата добавления: 2015-09-11; просмотров: 1786;
