Основне рівняння молекулярно-кінетичної теорії
Ідеальнимназивають газ, молекули якого – матеріальні точки, між якими відсутні сили взаємодії. Молекули в такому газі співударяються за законом співударяння пружних куль. Реальні гази поводять себе як ідеальний тоді, коли середня відстань між молекулами у багато разів перевищує їхні розміри, тобто коли розрідження досить велике.Тиск у посудині з газом зумовлений ударами молекул об стінки.
p = 1/3n0m0v2 основне рівняння МКТ -зв’язок між тиском (макроскопічним параметром) з такими мікроскопічними параметрами, як маса однієї молекули і середня квадратична швидкість руху молекул. Це рівняння можна подати й у іншому вигляді , p = 2/3n0E отже тиск ідеального газу пропорційний середній
кінетичній енергії хаотичного руху молекул. Основне рівняння МКТ газів підтверджує той факт, що чим більші маса молекули і їхні швидкості, а також концентрація молекул, тим більший тиск вони чинять на стінки посудини.
Вводячи постійну Больцмана К = 1,38 10-23 Дж/К, можна знайти вираз середньої кінетичної енергії поступального руху молекул через термодинамічну температуру: E=3/2 kT-рівняння Больцмана для енергії.
Р= n0 k T, або n0 = 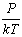 -приоднаковій температурі та тиску всі гази утримують в рівних об'єктах рівну кількість молекул – число Лошмідта.
-приоднаковій температурі та тиску всі гази утримують в рівних об'єктах рівну кількість молекул – число Лошмідта.
NЛ - молекул в 1м3 газу при нормальних умовах:
Nl= 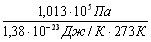 =2, 69 1025 м-3
=2, 69 1025 м-3
Дата добавления: 2015-09-11; просмотров: 962;
