ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Методичні вказівки для підготовки до лабораторних робіт
З курсу хімії
Частина 2 (Електрохімічні процеси)
Миколаїв 2003
УДК 041
Кельїна С.Ю. Методичні вказівки для підготовки до лабораторних робіт з курсу хімії. Частина 2. Електрохімічні процеси. Миколаїв: УДМТУ, 2003. – 71 с.
Кафедра хімії
Вказівки містять теоретичні довідки, необхідні для виконання лабораторних робіт з електрохімії. Окрім того наведені приклади розв’язання типових задач з відповідних тем, запропоновані вправи й задачі для самостійної підготовки та самоконтролю знань.
Вказівки призначені для студентів усіх спеціальностей.
Спис. літ. – 10 назв.
Рецензент канд.техн.наук., доц. Матвієнко В.М.
Український державний морський
технічний університет, 2003
Лабораторна робота № 9
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Реакції, які супроводжуються зміною ступенів окиснення елементів, що входять до складу реагуючих речовин, називаються окисно-відновними (ОВР).
Ступінь окиснення елемента (СО) – формальний заряд атома елемента в молекулі, якщо вважати, що молекула складається з гіпотетичних іонів.
Величину та знак ступеня окиснення атомів у сполуках визначають, виходячи з таких положень:
1. у нейтральних молекулах алгебраїчна сума ступенів окиснення всіх атомів дорівнює нулю;
2. у гомосполуках ступінь окиснення окремих атомів дорівнює нулю;
3. ступінь окиснення Оксигену у сполуках дорівнює –2. Винятком є пероксидні сполуки (Н2О2, Nа2О2), де формальний заряд на атомі Оксигену дорівнює –1; фториди (ОF2, O2F2), де СО дорівнює +2, +1 та деякі інші сполуки;
4. гідроген в більшості сполук має ступінь окиснення +1. Виняток складають гідриди металів (NaH, CaH2), у яких СО(Н) дорівнює –1;
5. флуор в усіх сполуках має ступінь окиснення –1;
6. ступінь окиснення елементів перших трьох груп головних підгруп дорівнює номеру групи (Na+1,Cа+2, Аl+3);
7. максимальний позитивний ступінь окиснення атомів відповідає номеру групи Періодичної системи. Винятком є елементи підгрупи Купруму (Cu, Ag, Au), де СО може бути +3, тобто більший, ніж номер групи, а також більшість металів восьмої групи (Fe, Co, Ni, Rh, Pd, Ir, Pt) та елементи О і F, в яких ступінь окиснення завжди менше, ніж номер групи.
Поняття “ступінь окиснення” не слід отожнювати з валентністю, навіть у тих випадках, коли їхні абсолютні значення співпадають. Валентність визначається числом зв’язків, які утворює даний атом з іншими атомами, тому ця характеристика не має знаку і не може дорівнювати нулю.
Наприклад, ступені окиснення Карбону в метані СН4, метанолі СН3ОН, формальдегіді НСОН та карбон (ІV) оксиді СО2 відповідно дорівнюють –4, –2, 0, +4, а валентність у всіх випадках дорівнює 4.
Якщо мова йде про ступеня окиснення, то спочатку пишеться знак, потім – цифра (О–2, С+4), при вказанні заряду реально існуючого іону пишуть цифру, потім – знак (Са2+, SO42–).
Не дивлячись на те, що поняття ступеню окиснення є досить умовним і формальним, воно набуло широкого використання при класифікації хімічних процесів і при розгляданні окисно-відновних реакцій.
В ОВР зміна СО зумовлена зміщенням або повним переходом електронів від атома одного елемента до атома іншого елемента.
Окисненням називається процес віддачі електронів.
Відновленням називається процес прийняття електронів.
Окисником називається речовина, що містить атоми елементу, які приймають електрони. В ОВР окисник відновлюється та його СО зменшується.
Відновником називається речовина, що містить атоми елементу, які віддають електрони. В ОВР відновник окиснюється та його СО збільшується.
Будь-який окисно-відновний процес можна умовно поділити на дві напівреакції - напівреакцію відновлення та напівреакцію окиснення.
Наприклад:
0 +1 +2 0
Zn + 2HCl ® ZnCl2 + H2.
Zn0 – 2ē ® Zn+2; напівреакція окиснення Zn; Zn0 – відновник.
H+ + 2ē ® H20; напівреакція відновлення Н2; Н+ – окисник.
Розрізняють такі типи ОВР: міжмолекулярні, внутрішньомолекулярні та реакції диспропорційнування (реакції самоокиснення-самовідновлення).
У міжмолекулярних ОВР атоми елементів-окисників і атоми елементів-відновників знаходяться у різних молекулах, наприклад:
+6 –2 0
H2SO4 + 3H2S ® 4S + 4H2O.
Для внутрішньомолекулярних ОВР характерна зміна ступенів окиснення у елементів, які знаходяться у одній молекулі, наприклад:
+5 –2 –1 0
2KClO3 ® 2KCl + 3O2.
У реакціях диспропорційнування один і той же елемент виступає як окисник і відновник одночасно. У таких реакціях речовина з проміжним ступенем окиснення розкладається на дві сполуки, в одній з яких ступінь окиснення вищий, а в другій – нижчий:
0 –1 +1
Cl2 + H2O ® HCl + HСlO;
+4 +5 +3
2NO2 + H2O ® HNO3 + HNO2.
При складанні рівнянь ОВР застосовують два методи: метод електронного та електронно-іонного балансів. Обидва методи грунтуються на умові, що в окисно-відновній реакції кількість електронів, що віддає відновник, дорівнює кількості електронів, що приймає окисник.
Метод електронного балансу
Основні правила складання реакцій за допомогою цього метода розглянемо на прикладі конкретної реакції.
Приклад 1.Записати рівняння реакції взаємодії нітратної кислоти з міддю.
Розв’язання:
1. Записують схему реакції:
Cu + HNO3 ® Cu(NO3)2 + NO2 + H2O.
2. Визначають ступені всіх елементів і знаходять окисник і відновник:
0 +1+5 -2 +2 +5 –2 +4 –2 +1 –2
Cu + HNO3 ® Cu(NO3)2 + NO2 + H2O.
Окисником буде атом Нітрогену, якій змінює свій ступень окиснення від +5 до +4, відновником - атом Купруму (ступінь окислення змінюється від 0 до +2).
3. Визначають кількість електронів, що віддає відновник і кількість електронів, що приймає окисник. Для цього складають рівняння, в яких кількість електронів, що віддаються або приймаються визначаються як різниця між ступенями окиснення елементів до та після реакції. Коефіцієнти біля окисника та відновника визначаються після поділення найменшого загального кратного обох чисел на кількість електронів у напівреакції й ставляться поза загальною рискою:
 1 Сu0 – 2ē ® Cu2+
1 Сu0 – 2ē ® Cu2+
2 N+5 + 1ē ® N+4.
Загальне кратне у нашому прикладі дорівнює двом.
4. Після цього розставляють коефіцієнти для інших речовин, що беруть участь у реакції, підраховуючи кількість атомів елементів у правій і лівій частині рівняння:
Cu + 4HNO3 ® Cu(NO3)2 + 2NO2 + 2H2O.
5. Підраховують баланс атомів Оксигену в обох частинах реакції:
n(O)лів = 4×3 = 12; n(O)пр = 6 + 4 + 2 = 12.
В ОВР, де присутні два і більше окисника або відновника, визначають загальне число електронів, що віддають відновники або приєднують окисники й далі розставляють коефіцієнти аналогічним способом. Наприклад:
3Cu2S + 22HNO3 ® 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.

 2 Cu+1 – 2ē ® 2Cu+2
2 Cu+1 – 2ē ® 2Cu+2
3 S–2 – 8ē ® S+6 10ē
10 N+5 + 3ē ® N+2
Метод електронно-іонного балансу
Метод електронно-іонного балансу дає можливість визначити коефіцієнти не тільки перед окисником і відновником, але й перед іншими членами рівняння. Він використовується, коли окисно-відновні процеси йдуть між реально існуючими іонами. Найчастіше такі процеси відбуваються у водних розчинах між електролітами.
Приклад 2. Записати реакцію взаємодії калій біхромату з ферум (ІІ) сульфатом у кислому середовищі.
Розв’язання:
1. Записують схему реакції, де вказуються вихідні речовини і продукти реакції; визначають окисник і відновник розрахунком ступенів окиснення окремих елементів;
+6 +2 +3 +3
К2Сr2O7 + FеSO4 + H2SO4 ® Cr2(SO4)3 + Fe2(SO4 )3 + H2O.
Сr2O72– – окисник, який відновлюється до Cr+3; Fе2+ – відновник, який окиснюється до Fе3+.
2. Записують електронно-іонні напівреакції, де вказуються не лише окисник або відновник у вигляді іонів або молекул, які реально існують у розчині, але й молекули води, іони Н+ або іони ОН–, якщо вони приймають участь у окисному чи відновному процесі; складають матеріальний і електронний баланс; визначають коефіцієнти в рівнянні поділенням найменшого загального кратного чисел відданих і прийнятих електронів на кількості електронів у напівреакціях:
 1 Сr2O72– + 14H+ + 6ē ® Cr+3 +7H2O
1 Сr2O72– + 14H+ + 6ē ® Cr+3 +7H2O
 3 2Fe+2 – 2ē ® 2Fe+3 .
3 2Fe+2 – 2ē ® 2Fe+3 .
3. Записують сумарне електронно-іонне рівняння, яке отримується при складанні відповідно лівих і правих частин напівреакцій з визначенням коефіцієнтів у вихідному рівнянні:
 1 Сr2O72– + 14H+ + 6ē ® Cr+3 +7H2O
1 Сr2O72– + 14H+ + 6ē ® Cr+3 +7H2O
 3 2Fe+2 – 2ē ® 2Fe+3
3 2Fe+2 – 2ē ® 2Fe+3
Сr2O72- + 14H+ + 6Fe+2 ® Cr+3 +7H2O + 6Fe+3.
4. Записують молекулярне рівняння з коефіцієнтами:
К2Сr2O7 + 6FeSO4 + 7H2SO4 ® Cr2(SO4)3 + 3Fe2(SO4 )3 + K2SO4 +7H2O.
5. Підраховують кількості атомів Оксигену в правій і лівій частині рівняння:
n(O)лів = 7 +24 + 28 = 59; n(O)пр = 12 + 36 + 4 + 7 = 59.
Виходячи з визначення еквіваленту, якщо водень виступає у ролі відновника або окисника, то 1 моль його атомів звільнює (або приєднує) 1 моль електронів.
0,5Н2 ® Н+ + ē; 0,5Н2 + ē ® Н-.
Еквівалентом окисника називається така його кількість, яка при відновленні приєднує 1 моль електронів. Еквівалентом відновника називається така його кількість, яка при окисненні звільнює 1 моль електронів.
Відповідно з цими визначеннями, молярна маса еквіваленту окисника МЕ(ок) або відновника МЕ(відн) дорівнює його молярній масі, поділеної на число електронів n у напівреакції:
МЕ(ок) = М(ок)/n, г/моль; МЕ(відн) = М(відн)/n, г/моль.
Оскільки одна й та ж сама речовина в різних реакціях може віддавати або приєднувати різну кількість електронів, то молярна маса окисно-відновного еквівалента може мати різні значення. Розглянемо це на конкретному прикладі.
Приклад 3.Визначити молярну масу еквіваленту КМnO4 в окисно-відновних реакціях, які відбуваються у кислому, нейтральному та лужному середовищах.
Розв’язання:
1. МЕ(КМnO4) у кислому середовищі – ?
Запишемо напівреакцію відновлення MnO4– у кислому середовищі:
MnO4– + 8H+ + 5ē ® Mn2+ + 4H2O.
МЕ(КМnO4) кисл = МЕ(КМnO4)/5 = 158,1/5 = 31,6 г/моль.
2. МЕ(КМnO4) у нейтральному середовищі –?
Запишемо напівреакцію відновлення MnO4– у нейтральному середовищі:
MnO4– + 2Н2О + 3ē ® MnО2 + 4OН–.
МЕ(КМnO4) нейтр = МЕ(КМnO4)/3 = 158,1/3 = 52,7 г/моль.
3. МЕ(КМnO4) у лужному середовищі – ?
Запишемо напівреакцію відновлення MnO4– у лужному середовищі:
MnO4– + 1ē ® MnO42–.
МЕ(КМnO4) лужн = МЕ(КМnO4)/1 = 158,1/1 = 158,1 г/моль.
Відповідь: МЕ(КМnO4)кисл = 31,6 г/моль, МЕ(КМnO4)нейтр = 52,7 г/моль,
МЕ(КМnO4)лужн = 158,1 г/моль.
Окисники та відновники
До окисників належать речовини, які містять у своєму складі елемент, атоми якого мають виражену тенденцію до приєднання електронів. Наприклад, окисниками є кисень, вільні галогени, сполуки металів у високих ступенях окиснення (КMnО4, К2MnО4, MnО2, К2Cr2О7, PbО2 тощо), сполуки галогенів з позитивними ступенями окиснення (НClO, HClO2, HІO3, HBrO4), сполуки Нітрогену (HNO3, N2O5, NO2, N2O), концентрована сульфатна кислота H2SO4, пероксид водню Н2О2 та деякі інші сполуки.
Всі окисники містять у своєму складі атоми, що мають нестабільну електронну конфігурацію, а до утворення стійкої конфігурації не вистачає декількох електронів. Приєднуючи електрони, вони знижують свою ступінь окиснення.
З хімічних окисників найчастіше використовуються сполуки КMnO4 (калій перманганат) та К2Cr2О7 (калій біхромат). Найбільшу окисну здатність вони мають у кислому середовищі. Іони Сr2O72– померанчового кольору й відновлюються у Cr3+ темно-зеленого кольору; іони MnO4– мають темно-малиновий колір і при відновленні утворюють безкольорові іони Mn2+:
Сr2O72– + 14H+ + 6ē ® Cr3+ +7H2O;
MnO4– + 8H+ + 5ē ® Mn2+ + 4H2O.
В нейтральному середовищі іони MnO4– відновлюються до МnО2 – осаду коричневого кольору, в лужному – до іонів MnO42– яскраво-зеленого кольору за такими рівняннями:
MnO4– + 2Н2О + 3ē ® MnО2 + 4OН–;
MnO4– + 1ē ® MnO42–.
До відновників належать речовини, що містять у своєму складі елементи, здатні віддавати електрони. Відновниками є метали у вільному стані (особливо лужні та лужно-земельні), водень, вуглець, сполуки неметалів з найменшими ступенями окиснення (Н2S, Н2Se, NН3, PН3, AsН3, НІ, НBr, НCl тощо). Взагалі, відновником може бути атом або іон у будь-якому, крім максимально можливого ступеню окиснення.
Часто в ролі відновників використовують солі сульфітної та тіосульфатної кислот, кислотні залишки яких окиснюються до сульфат-іону:
SO32– + H2О - 2ē ® SO42– + 2H+;
S2O32– + 5H2О - 10ē ® 2SO42– + 10H+.
Сполуки з елементами у проміжних ступенях окиснення залежно від умов можуть виявляти окисні або відновні властивості. Наприклад, нітрит-іон в залежності від реакції може бути відновником або окисником:
+3 +5
3NaNO2 + HClO3 ® 3NaNO3 + HCl;
+3 0
NH4Cl + NaNO2 ® N2 + 2H2O + NaCl.
Здатність атомів елементів до прийому або віддачі електронів можна оцінити за допомогою відносної електронегативності (c). Елементи-окисники мають високі значення c(4,0...2,5). Найактивніші окисники розміщені у правому верхньому куті Періодичної системи. Це Флуор, Оксиген, Хлор, Бром, Сульфур. Відновники мають cменшу за 2,5. Типові елементи-відновники розміщені у лівому нижньому куті Періодичної системи. Це Францій, Рубідій, Кальцій, Калій, Барій. Найбільш поширені окисники та відновники, а також їх напівреакції дивиться у додатку.
Відомо, що напрямок перебігу процесів визначається з умови DG0реак < 0. Для окисно-відновних процесів DG0реак розраховується за формулою
DG0реак = – nEF,
де n – кількість електронів у сумарному молекулярно-іонному рівнянні окис- но-відновного процесу; Е – електрорушійна сила (ЕРС) гальванічного еле-менту, утвореного електродами, на яких відбуваються окисні та відновні процеси; F – число Фарадея, 96500 Кл/моль-екв.
Для виконання цієї умови необхідно, щоб ЕРС була позитивною. ЕРС гальванічного елементу розраховується за формулою:
Е = j0окис – j0відн.
Значення стандартних потенціалів окисно-відновних реакцій знаходять у таблицях. Потенціал окисника завжди більше потенціалу відновника. Чим більш позитивне значення потенціалу, тим сильнішим окисником є система. (Поняття електрорушійної сили гальванічного елементу та потенціалу розглянуті в розділі “Гальванічні елементи”).
Визначення напрямку перебігу ОВР розглянемо на конкретному прикладі.
Приклад 4. Визначити напрямок перебігу окисно-відновної реакції:
Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O « К2Сr2O7 + 6FeSO4 + 7H2SO4. Порівняти окисні властивості іонів MnO4– та Сr2O7–2 у кислому середовищі.
Розв’язання:
1. Визначення напрямку реакції:
Сr2O72– + 14H+ + 6ē « Cr3+ +7H2O; j0 = +1,36 В.
2Fe3+ + 2ē « 2Fe2+ ; j0 = +0,77 В.
Сr2O72– – окисник , Fe2+ – відновник, тобто напівреакції мають напрямок:
Сr2O72– + 14H+ + 6ē ® Cr3+ +7H2O;
2Fe2+ - 2ē ® 2Fe3+;
Е = j0окис – j0 відн = +1,36 – (+0,77) = +0,79 В.
DG0реак = – nEF = –6·0,79·96500 = –457410 Дж/моль. Реакція відбува-ється з права наліво:
К2Сr2O7 + 6FeSO4 + 7H2SO4 ® Cr2(SO4)3 + 3Fe2(SO4 )3 + K2SO4 +7H2O.
2. Порівняння окисних властивостей іонів MnO4– та Сr2O72– у кислому середовищі.
Іон MnO4– більш сильний окисник, ніж Сr2O72–, тому що стандартний потенціал напівреакції відновлення MnO4– (+1,51 В) більше, ніж стандартний потенціал напівреакції відновлення Сr2O72– (+1,36 В).
В багатьох випадках треба знати не тільки напрямок процесу, але й наскільки повно він відбувається. Наприклад, у кількісному аналізі використовуються тільки такі реакції, які практично відбуваються на 100 %. Ступінь перебігу реакції визначається константою рівноваги, яку можна розрахувати за формулою
DG0 = –RT×lnK. Оскільки DG0реак = –nEF, lgK = 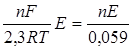 ; звідки K =
; звідки K = 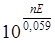
Приклад 6. Визначити константу рівноваги для реакції
Zn + CuSO4 ® Cu + ZnSO4.
Розв’язання:
1. ЕРС - ?
Zn0 – 2ē ® Zn+2, Zn0 - відновник; j0відн = -0,76 В.
Cu+2 + 2ē ® Cu0, Cu+2 - окисник; j0окис = +0,34 В.
Е = j0окис - j0 відн = 0,34 – (-0,76) = 1,1 В.
2. K - ?
K = 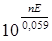 =
= 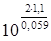 = 1037,3.
= 1037,3.
Величина константи рівноваги показує, що практично реакція відбувається до кінця.
Відповідь: K = 1037,3.
Питання та задачі
1. Сформулювати поняття “ступінь окислення” та навести приклад визначення цієї характеристики для елементів у сполуках СО2, Н2S, HNO3, Н3PO4.
2. Визначити ступінь окиснення елементів у наведених сполуках: Na2SO4, KМnO4, MnO2, K2Cr2O7, H3PO4, MoO3, Na2S2O3, K4[Fe(CN)6], Na3[AlF6].
3. Сформулювати поняття “окисник”. Навести приклади типових окисників.
4. Сформулювати поняття “відновник”. Навести приклади типових відновників.
5. Які бувають типи окисно-відновних реакцій? Навести приклади.
6. Чи можливо розчин ферум (ІІ) сульфату зберігати у нікелевій судині?
7. Що буде відбуватися, якщо розчин ферум (ІІ) нітрату перемішувати алюмінієвою ложкою?
8. Скласти рівняння окисно-відновних реакцій і розставити коефіцієнти:
Cu + HNO3 ®
KMnO4 + H2SO4 + KI ®
K2Cr2O7 + H2S + H2SO4 ®
KMnO4 + H2O + KNO2 ®
KMnO4 + KOH + Na2SO3 ®
Zn + HNO3 ®
Fe(OH)2 + H2O + O2 ®
9. Розставити коефіцієнти в окисно-відновних реакціях методом електронно-іонного балансу:
S + KOH ® K2S2O3 + H2O;
HClO3 ® HClO4 + ClO2;
(NH4)2Cr2O7 ® N2 + Cr2O3 + H2O;
Cu2O + HNO3 ® NO + Cu(NO3)2;
Sn + NaOH + H2O ® H2 + Na2[Sn(OH)4].
10. Визначити напрямок окисно-відновних процесів:
Cr2(SO4)3 + I2 + H2O « K2Cr2O7 + H2SO4 + KI;
FeCl3 + Na2SO3 + H2O « FeCl2 + Na2SO4 + HCl;
Zn(NO3)2 + 2 NO + 4 H2O « Zn + 8 HNO3.
Значення потенціалів окисно-відновних напівреакцій взяти з довідкових таблиць.
11. Чи буде MnO2 у кислому середовищі окиснювати НВr?
12. Визначити, чи буде реагувати Pb з розбавленими НСl та HNO3?
13.
Дата добавления: 2015-09-18; просмотров: 5314;
