Метод валентних зв’язків.
Основні положення:
ü ковалентний хімічний зв’язок утворюється двома електронами з протилежно спрямованими спінами; при цьому спільна електронна пара, що виникає, належить обом атомам; зв’язок є двоцентровим;
ü ковалентний зв’язок тим міцніший, чим більшою мірою перекриваються електронні хмари взаємодіючих атомів, тому ковалентний зв’язок утворюється в тому напрямку, де це перекривання максимальне.
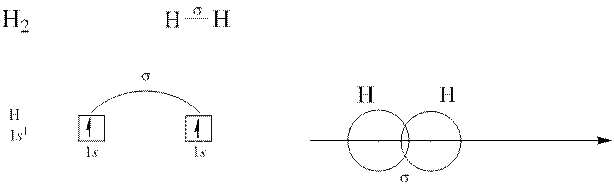
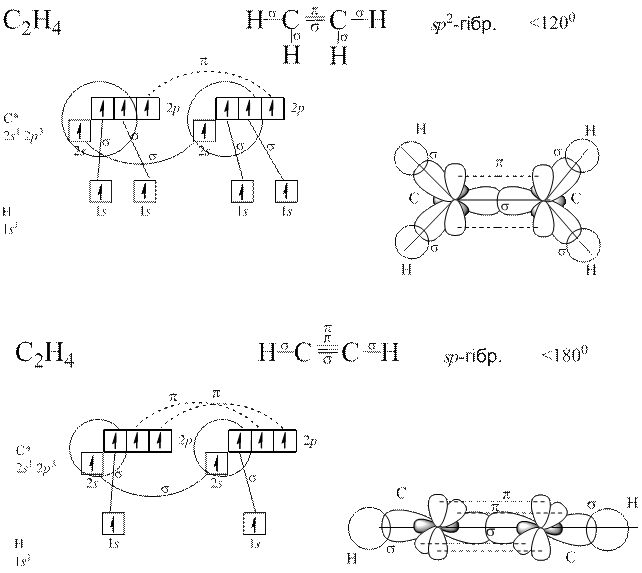
Коли перекривання атомних орбіталей відбувається вздовж ліній, що сполучають ядра атомів, утворюється 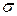 – зв’язок.
– зв’язок.
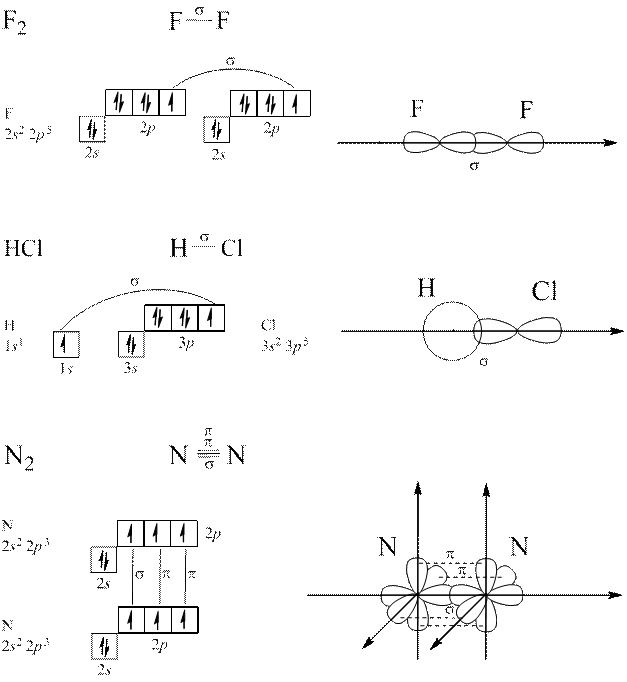
У разі утворення кратних (подвійних чи потрійних) зв’зків крім  – зв’язку виникає
– зв’язку виникає 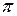 – зв’язок – перпендикулярно ліній, що сполучають ядра атомів.
– зв’язок – перпендикулярно ліній, що сполучають ядра атомів.
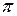 – зв’язок може виникати лише після утворення
– зв’язок може виникати лише після утворення 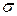 – зв’язку, тобто
– зв’язку, тобто 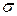 – зв’язок утворюється першочергово.
– зв’язок утворюється першочергово.
Напрямленість ковалентного зв’язку.
Зв’язок утворюється у напрямку одноелектронної орбіталі, оскільки саме там може виникнути найбільше перекривання орбіталей.
Насиченість ковалентного зв’язку.
Число зв’язків, що може утворювати певний атом, за механізмом спарювання електронів відповідає наявному числу його одноелектронних орбіталей у нормальному чи збудженому станах.
Наприклад, якщо атом S в нормальному стані має дві одноелектронних орбіталі, він утворює два зв’язки.
Неполярний ковалентний зв’язок утворюється між атомами з однаковою електронегативністю 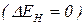 . Спільні електронні пари локалізуються симетрично відносно ядер.
. Спільні електронні пари локалізуються симетрично відносно ядер.


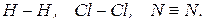
Полярний ковалентний зв’язок утворюється між атомами з різною електронегативністю. 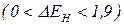 . Спільна електронна пара зміщується до більш електронегативного атома. На ньому виникає негативний заряд.
. Спільна електронна пара зміщується до більш електронегативного атома. На ньому виникає негативний заряд.
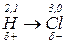
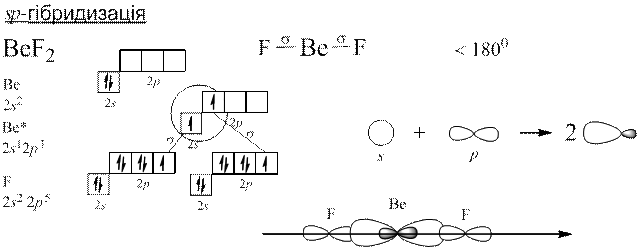
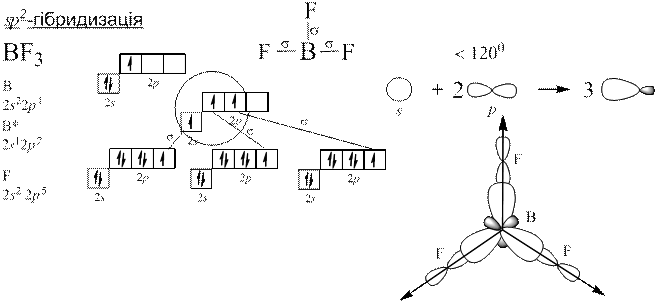
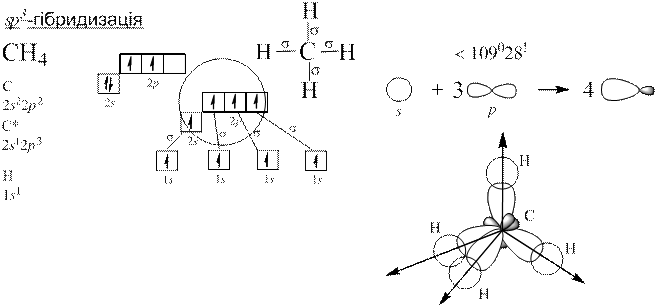
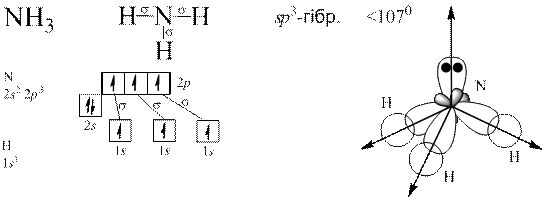
Теорія Слетера і Полінга: електронні орбіталі центрального атома, які спочатку відрізнялися між собою за енергією, а отже, за формою та просторовим розміщенням до збудження, можуть перетворитися на таке саме число енергетично рівноцінних орбіталей після збудження. Такі орбіталі називаються гібридизовані.
Гібридизація полягає у виникненні енергетично рівноцінних орбіталей у разі утворення хімічного зв’язку з початково нееквівалентних атомних орбіталей.
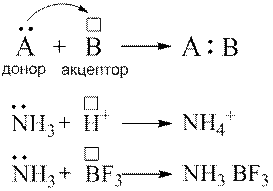
Донорно-акцепторний механізм утворення ковалентного зв’язку.
Спільна електронна пара може утворюватись не тільки за рахунок спарювання електронів, що належать орбіталям окремих атомів, а й внаслідок взаємодії неподіленої електронної пари одного атома та вільної орбіта лі іншого:
Донорно-акцепторний механізм утворення ковалентного зв’язку відіграє важливу роль у разі утворення комплексних сполук.
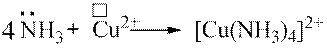
Дата добавления: 2015-09-02; просмотров: 2364;
