Лабораторная работа № 4.
Проведение опытов частных реакций катионов III группы (алюминия, цинка, хрома, марганца, железа).
Цель:
- изучение частных реакций катионов III группы (алюминия, цинка, хрома, марганца, железа;
- выполнение анализа смеси катионов III группы.
Ход работы: Задание 1: Проделать частные реакции катионов III группы (алюминия, цинка, хрома, марганца, железа). Результаты работы оформлять в виде таблицы:

Реакции катиона А13+.
Реакция с групповым реактивом - сульфидом аммония (NH4)2S. Групповой реактив осаждает катион А13+ в виде гидроксида:
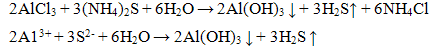
Осадок гидроксида алюминия растворим в разбавленных кислотах Проведение реакции: В пробирку прилить 2-3 капли соли алюминия и добавить 3-4 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Наблюдать выпадение осадка белого цвета. В пробирку с осадком прилить 5-6 капель раствора соляной кислоты НС1. Наблюдать растворение осадка. Реакция с щелочами NaOH или КОН.
Катион А13+ с гидроксидом натрия или калия образует амфотерный осадок - гидроксид алюминия:
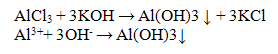
Гидроксид алюминия обладает амфотерными свойствами, растворяется в кислотах, проявляя при этом свойства основания
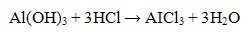
и свойства слабой кислоты, взаимодействуя со щелочами
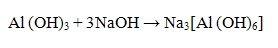
Проведение реакции: В пробирку прилить 4-5 капель соли алюминия, затем 1-2 капли раствора гидроксида калия КОН или натрия NaOH. Наблюдать выпадение осадка белого цвета. Полученный осадок разделить на две части, к одной части прилить раствор соляной кислоты HCl, а к другой избыток щелочи. Наблюдать растворение осадка в обеих пробирках. Реакция с гидроксидом аммония NH4OH.
Катион А13+ с гидроксидом аммония образует белый осадок гидроксида алюминия, нерастворимый в избытке гидроксида аммония:
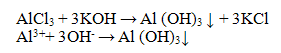
Проведение реакции: В пробирку прилить 3-4 капли раствора соли алюминия и 2-3 капли раствора гидроксида аммония NH4OH. Наблюдать выпадение осадка белого цвета. Испытать осадок на избыток раствора гидроксида аммония, добавив ещё 5-6 капель раствора NH4OH. Реакция с ализарином - качественная реакция.
Ализарин с катионом Al3+ образует соль красного цвета «алюминиевый лак», нерастворимую в уксусной кислоте. Реакцию следует выполнять в слабокислом растворе при рН 4,2 - 4,6. Ионы Fe3+, Zn2+,Сг3+ мешают выполнению реакции, так как тоже образуют окрашенные «лаки».
Проведение реакции: К нескольким каплям соли алюминия прибавшь раствор гидроксида калия КОН или натрия NaOH до сильнощелочной среды. К раствору прибавить 1-2 капли спиртового раствора ализарина. Жидкость окрасится в фиолетовый цвет. Внесите в нее по каплям раствор уксусной кислоты CН3COOH до кислой реакции рН 4,2 - 4,6. Наблюдать окрашивание раствора красного цвета.
Реакции катиона Fе3+.
Реакция с групповым реактивом - сульфидом аммония (NH4)2S.
Групповой реактив осаждает катион Fe3+ в виде сульфида железа (III) черного цвета:
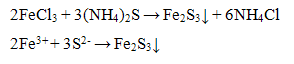
Осадок сульфида железа (III) растворяется в разбавленных кислотах
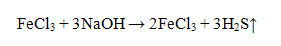
Проведение реакции: В пробирку прилить 2-3 капли соли железа (III) и добавить 3-4 капли свежеприготовленного раствора сульфида аммония (NH4)2. Наблюдать выпадение осадка черного цвета. В пробирку с осадком прилить 5-6 капель раствора соляной кислоты HCI. Наблюдать растворение осадка. Реакция с щелочами КОИ или NaOН.
Катион Fe3+ с щелочами образует осадок гидроксида железа (III) красно-бурого цвета:
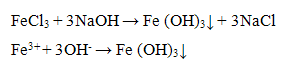
Осадок гидроксида железа (III) растворим только в кислотах
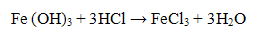
Проведение реакции: В пробирку прилить 2-3 капли соли железа (III) и добавить 3-4 капли раствора гидроксида калия КОH или натрия NaOH. Наблюдать выпадение осадка красно-бурого цвета. Осадок разделить на две части, к одной части добавить раствор соляной кислоты HCl а к другой - раствор щелочи. В пробирке с кислотой наблюдать растворение осадка Реакция с роданидом аммония NH4SCN - качественная реакция, специфическая реакция.
Катион Fe3+ с роданидом аммония NH4SCN образует роданид железа (III) Fe(SCN)3, который окрашивает раствор в кроваво-красный цвет
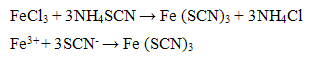
Проведение реакции: В пробирку прилить 3-4 капли раствора соли железа (III), добавить каплю раствора роданида аммония NH4SCN. Наблюдать образование раствора кроваво - красной окраски.
Реакция с гексацианоферратом (II) калия (желтая кровавая соль) K4[Fe(CN)6] - качественная реакция, специфическая реакция.
Катион Fe с гексацианоферратом (II) калия K4[Fe(CN)6] образует в кислой среде осадок темно-синего цвета «берлинская лазурь»:
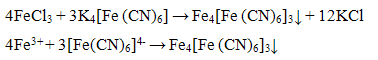
Проведение реакции: В пробирку прилить 2-3 капли раствора соли железа (III), добавить 1-2 капли раствора соляной кислоты HCI и 1-2 кайли раствора гексацианоферрата (II) калия K 4[Fe(CN)6]. Наблюдать выпадение осадка темно-синего цвета.
Реакции катиона Zn2+.
Реакция с групповым реактивом - сульфидом аммония (NН4)2S. Групповой реактив осаждает катионы Zn2+ в виде сульфида цинка белого цвета
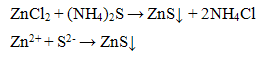
Осадок сульфида цинка растворим в разбавленных кислотах
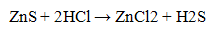
Проведение реакции: II пробирку прилить 2 - 3 капли соли ципка и добавить 3 - 4 капли жеприготовленного раствора сульфида аммония (NH4)2S. Наблюдать выпадение осадка белою цвета. В пробирку с осадком прилить 5 - 6 капель раствора соляной кислоты HCI. Наблюдать растворение осадка. Реакция с щелочами КОН или NaOH.
Катион Zn2+ с щелочами образует осадок гидроксида цинка белого цвета:
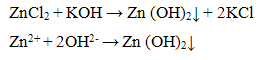
Гидрокcид цинка обладает амфотерными свойствами, растворяясь в кислоте
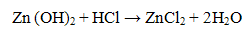
и в избытке щелочи, проявляя свойства слабой кислоты
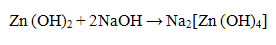
Проведение реакции: В пробирку прилить 2-3 капли соли цинка и добавить 1-2 капли раствора гидроксида калия КОН или натрия NaOH. Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части прилить 5-6 капель раствора соляной кислоты НО, а к другой - 5-6 капель раствора щелочи Наблюдать растворение осадка в обеих пробирках. Реакция с гидроксидом аммония NН4ОН.
Катион Zn2+ с гидрокендом аммония дает осадок гидроксида цинка белого цвета:
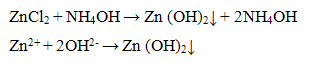
Осадок гидроксида цинка растворяется в избытке гидроксида аммония NH.,OI I с образованием компелксного иона [Zn(NH3)4]2+
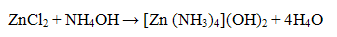
Проведение реакции: В пробирку прилить 2-3 капли соли цинка и добавить 1 - 2 капли раствора гидроксида аммония NH4OH. Наблюдать выпадение осадка белого цвета. В пробирку с осадком прилить 5-6 капель раствора гидроксида аммония. Наблюдать растворение осадка Реакция с дитизоном - качественная реакция.
Раствор дитпзона с катионами Zn2+ образует внутрикомплсксную соль малиново-красною цвета.
Проведение реакции: На полоску фильтровальной бумаги капнуть 1 - 2 капли раствора днтизона и 1 - 2 капли соли цинка. Наблюдать появление красного пятна на зеленом фоне. Реакции катиона Мn2+.
Реакция с групповым реактивом - сульфидом аммония (NH4)2S Групповой реактив осаждает катионы Мn2+ в виде сульфида марганца телесного цвета:
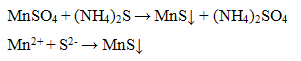
Осадок сульфида марганца растворяется в разбавленных кислотах
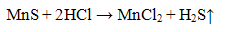
Проведение реакции: В пробирку прилить 2 - 3 капли соли марганца и добавить 3-4 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Наблюдать выпадение осадка телесного цвета. В пробирку с осадком прилить 5-6 капель раствора соляной кислоты HCI, Наблюдать растворение осадка. Реакция с щелочами КОH или NaOH.
Катион Мп2+ с щелочами образует гндроксид марганца белого цвета» который на воздухе окисляется, изменяя свою окраску до желто-бурого цвета:
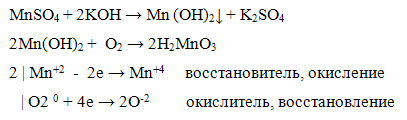
Проведение реакции: В пробирку прилить 2-3 капли соли марганца и добавить 2-3 капли раствора гидроксида калия КОH или натрия NaOH. Наблюдать выпадение осадка белого цвета, который туг же начнет менять свою окраску на желто-бурую.
Реакция окисления кат и она Мn2+ до Мn7+ - качественная реакция, специфическая реакция.
Эта реакция используется для открытия катиона Мn2+. Окисление катиона Мn2+ можно производить висмутатом натрия NaBiO3 в присутствии избытка концентрированной азотной кислоты. Цвет раствора изменяется от бесцветного до фиолетово-красного:

Проведение реакции: В пробирку прилги, 2 - 3 капли раствора соли марганце (II) и 5 - 6 капель раствора конц. азотной кислоты HNO3, затем бросить кристаллы висмутата натрия NaBiO3. Смесь перемешать и дать отстояться. Наблюдать изменение окраски раствора от розовой до фиолетово-красной.
Реакции катиона Сr3+.
Реакция с групповым реактивом - сульфидом аммония (NH4)2S.
Групповой реактив осаждает катионы Сr3+ в виде гидроксида хрома (III) серо-зеленого цвета:
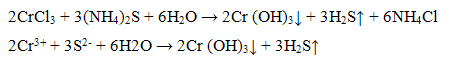
Осадок гидроксида хрома (III) обладает амфотерными свойствами и растворяется в кислотах и щелочах.
Проведение реакции: В пробирку прилить 2 - 3 капли соли хрома (III) и добавить 3 - 4 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Наблюдать выпадение осадка серо-зеленого цвета. В пробирку с осадком прилить S-6 капель раствора соляной кислоты НСl. Hаблюдать растворение осадка.
Реакция с щелочами КОH пли NaOH.
Катион Cr3+ с шеломами образует серо-зеленый осадок гидроксида хрома (III):
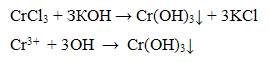
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь в кислотах и щелочах
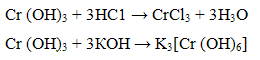
Проведение реакции: В пробирку прилить 2 - 3 капли соли хрома (III) и добавить 1 - 2 капли раствора гидроксида калия КОН или натрия NaOH. Наблюдать выпадение осадка серо-зеленого цвета. Осадок разделить на дне части, к одной части добавить раствор соляной кислоты ИСК а к другой - раствор щелочи. Наблюдать растворение осадка в обеих пробирках.
Реакция окисления катиона Сг3+ до Сr6+ - качественная реакция, специфическая реакция.
Катионы Сr3+ окисляются сильными окислителями в кислой среде до дихромат-ионов Сr2O7 2-. В щелочной среде можно применять более слабые окислители и окислить Сr3+ до хромат-ионов СrС4 2-. При окислении Сг3+ в кислой среде в качестве окислителей применяют перманганат калия КМnО4, персульфат аммония (NH4)S2O8 и др. При окислении Сr3+ в щелочной среде используют хлорную или бромную воду (Сl2, Вl2), пероксид водорода H2О2 и др. Окисление сопровождается изменением окраски раствора от зеленого до желтого цвета.
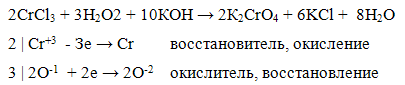
Проведение реакции: В пробирку прилить 2 - 3 капли соли хрома (III), добавить кристаллы сухой щелочи (КОН или NaOН) и 3 - 5 капель раствора пероксида водорода Н2О2. Смесь кипятить до перехода зеленой окраски раствора в желтую. Полученную смесь разделить на две части, Первую часть использовать для идентификации хромат-иона СrО4 2- добавив 1 - 2 капли раствора хлорида бария ВаСl2. Наблюдать образование осадка желтого цвета. Вторую часть использовать в следующем опыте. Реакция с бензндином - качественная реакция.
Хромат-ион CrO4 2- окисляет беизидин до бензндиновой сини. При выполнении реакции должны отсутствовать другие окислители.
Проведение реакции: На фильтровальную бумагу капнуть 1 - 2 капли раствора бензидииа и в центр пятна капнуть раствор, оставшийся после окисления катиона Сr3+ до Сr6+ Наблюдать появление синего пятна.
Задание 2: Составить схему анализа смеси катионов III группы, используя текст методического пособия (см. «ЛАБОРАТОРНАЯ РАБОТА № 5»).
Контрольные вопросы:
1. Что называют амфотерностью?
2. Какие катионы третьей Группы ЯВЛЯЮТСЯ амфотерными? Напишите уравнения реакций, подтверждающие амфотерные свойства названных вами катионов?
3. Напишите уравнение реакции взоимодействия хромата калия с хлоридом бария. Уравнение реакции запишите в молекулярном и ионном видах.
4. Определите степени окисления химических элементов в следующих веществах
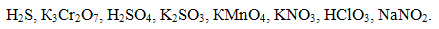
5. Какие из указанных процессов представляют собой окисление, а какие - восстановление:
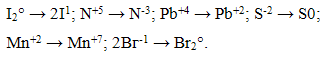
6. Уравняйте следующие окислительно-восстановительпые реакции методом электронного баланса.
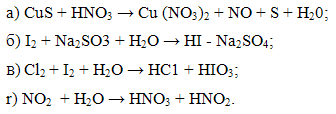
Дата добавления: 2015-11-10; просмотров: 10507;
