Вторая аналитическая группа катионов.
Общая характеристика катионов второй аналншческой группы. Их значение в тех но химическом контроле.
Ко второй аналитической группе катионов относятся ионы Ва2+, Са2+, Mg2+.Элементы этих катионов находятся во II группе главной подгруппе ПСXЭ. Гидроксиды бария Ва(ОН)2 и кальция Са(ОН)2 хорошо растворяются в воде, образуя щелочи. Гидроксид магния проявляет свойства слабого основания. Отличительной особенностью катионов второй группы от первой группы является то, что они образуют нерастворимые в воде карбонаты. Эти осадки хорошо растворимы в сильных кислотах HCl, НNO3 (кроме H2SO4) и в слабой уксусной кислоте СН3СООН. Следовательно, карбонат аммония (NН4)2СО3 может, быть групповым реактивом катионов второй группы только в нейтральной или в слобо-щелочной среде. Сульфиты катионов второй группы хорошо растворимы в воде. Этим они отличаются от катионов третьей и четвертой групп, сульфиды которых нерастворимы в воде. Сульфат магния MgSO4 в воде растворим, сульфат кальция CaSO4 мало растворим, сульфат бария ВaSO4 нерастворим в воде и сильных кислотах. Кислые соли катионов второй группы растворимы в воде. Катионы второй группы устойчивы к действию окислителей и восстановителей. Катионы Ва2+ и Са2+ бесцветны. Их летучие соединения окрашивают пламя газовой горелки в характерные цвета.
Катионы Са2+ и Mg2+ содержатся в молоке. В сыром молоке среднее содержание кальция 0,12%. Молоко в продуктах питания определяют пo содержанию кальция. Реактивы катионов второй группы: хромат калия К2СrО4, оксалат аммония (NH4)2CО3, серная кислота H2SO4 - применяются при анализе продуктов питания.
Лабораторная работа № 2.
Проведение опытов частных реакций катионов II группы (барин, кальция, магния).
Цель: - изучение частных реакций катионов II группы (бария, кальция, магния); - выполнение анализа смеси катионов II группы
Ход работы
Задание1: Проделать частные реакции катионов И группы (бария, кальция, магния). Результаты работы оформить в виде таблицы.

Реакции катиона Са2+.
Реакция с карбонатом аммония (NН4)2СО3
Катион Са2+ с групповым реактивом (NН4)2СО3 образует белый аморфный осадок карбоната кальция, при нагревании переходящий в крупнокристаллический:
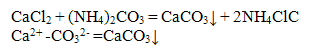
Для более полного осаждения катиона Са2+ реакцию следует проводить в аммиачной среде. Осадок СаСОз растворим и разбавленных соляной, азотной и уксусной кислотах:
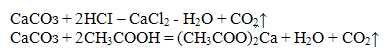
Проведение реакции: В пробирку прилить 2-3 капли раствора соли кальция и 1-2 капли раствора гидроксида аммония NH4OH. Пробирку со смесью нагреть на водяной бане, после чего в пробирку прибавить 2-3 капли карбоната аммония (NН4)2CO3. Наблюдать выпадение осадка. Осадок разделить на две части, к одной части добавить раствор соляной кислоты, а к другой раствор уксусной кислоты. Наблюдать растворение осадка в обеих пробирках. Реакция с о к с а л а т о м аммония (NH4)2C204 - качественная реакция.
Катион Са2' с океадатом аммония (NH4)2C2О4 образует белый кристаллический осадок оксалата кальция:
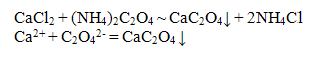
Реакция осаждения Са2+ используется при определении полноты вложения молока в супах Осадок растворим в сильных кислотах и нерастворим в уксусной кислоте (даже при нагревании па водяной бане):
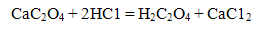
Проведений реакции: В пробирку налить 2-3 капли раствора соли кальция и столько же раствора оксалата аммония (NН4)2С2О4. Наблюдать выпадение осадка. Осадок разделить на две части, к одной части прилить раствор соляной кислоты, а к другой - раствор уксусной кислоты. Наблюдать растворение осадка только в соляной кислоте.
Реакции катиона Ва2+.
Реакция с карбонатом а м м о и и я (NH4)2CO3.
Катион Ва2+ с групповым реактивом (NH4)2CO3 образует белый аморфный осадок карбонат бария, при нагревании переходящий в крупнокристаллический:
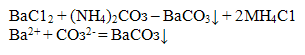
Для более полного осаждения катиона Ва реакцию следует проводить в аммиачной среде. Осадок BaCO3 растворим в разбавленных сильных кислотах (кроме H2SO4) и слабой уксусной:
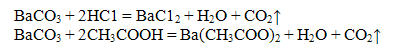
Проведение реакции: В пробирку налить 2-3 капли раствора соли бария, 1-2 капли раствора гидроксида аммония NН4ОН. Пробирку со смесью нагреть па водяной бане, после чет в пробирку прилить 2-3 капли раствора карбоната аммония (NH4)2СО3 Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить раствор соляной кислоты, а к другой - раствор уксусной кислоты. Наблюдать растворение осадка в обеих пробирках.
Реакция с хроматом калия К2СrO4 - качественная реакция.
Катион Ва2+ с реактивом К2СrO4 образует осадок хромат бария желтого цвета:
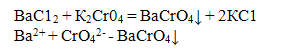
Другие катионы второй группы с хроматом калия осадка не дают. Катионы Ва2+ можно обнаружить и исследуемом растворе хроматом калия только в нейтральной или слабокислой среде, так как и сильных кислотах осадок ВаCrO4 растворяется
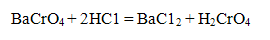
Проведение реакции: В пробирку прилили 2-3 капли раствора соли бария и столько же раствора хромата калия K2CrO4. Наблюдать выпадение осадка желтого цвета. Осадок разделить на две части, к одной части осадка добавить раствор соляной кислоты» к другой раствор уксусной кислоты. Наблюдать растворение осадка в соляной кислоте.
Реакция с серной к и с л о т о и Н2SO4 (или растворимыми сульфатами).
Катион Ва2+ образует с серной кислотой H2SO4 или с ее растворимыми солями Na3SO4, K2SO4, (NH4)SO4 белый кристаллический осадок сульфат бария:
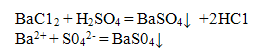
Осадок BaSO4 нерастворим ни в кислотах, пи в щелочах Проведение реакции: В пробирку прилить 2-3 капли раствора соли бария и I-2 капли раствора серной кислоты или раствора соли серной кислоты. Наблюдать выпадение осадка белого цвета.
Реакции катиона Mg2+.
Реакция с щелочами NaOH или КОИ.
Катион Mg2 с сильными щелочами образует аморфный осадок гидроксида магния белого цвета:
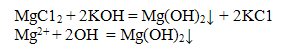
Осадок гидроксида магния Mg(OН)2 растворим в pact ворах аммонийных солей, сильных и слабых кислотах
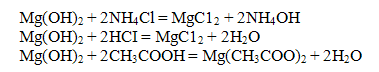
Проведение реакции: В пробирку прилить 2-3 капли раствора соли магния и столько же раствора сильной щелочи NaOН или КОН. Наблюдать выпадение осадка. Осадок разделить па три части. К первой части добавить раствор соли аммония NH4CI, ко второй - раствор соляной кислоты, к третьей раствор уксусной кислоты. Наблюдать растворение осадков.
Реакция с гидрофосфатом натрия Na2НPO4 - качественная реакция.
Катион Мg2+ в присутствии гидроксида аммония образует белый кристаллический осадок двойной соли фосфат магния-аммония:
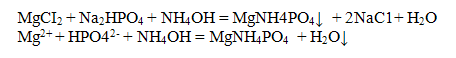
При осаждении MgNН4PO4 следует добавлять небольшой избыток раствора соли аммония NH4CI, чтобы не образовался аморфный осадок Mg(OН)2.
Катионы Са2+ и Ва2+ мешают обнаружению катиона Mg2+ , так как образуют осадки схожие по цвету и по форме с осадком, образуемым катионом Mg2+.
Проведение реакции: В пробирку прилить 2-3 капли раствора соли магния и столько же раствора хлорида аммония NН4Cl затем 3-5 капель раствора гидрофосфата натрия Na2HPO4. Тщательно перемешать содержимое и добавить водили раствор аммиака NH4OH до щелочной реакции Наблюдать выпадение осадка белого цвета.
Задание2: Составить схему анализа смеси катионов II группы, используя текст методического пособия. Анализ смеси катионов II группы.
Катион Ва2+ мешает Открытию катионов Са2+ и Mg2+. Катион Ba2+ может быть открыт и отделен специфическим реактивом хроматом калия K2CrO4. Kaтион Са2+ мешает открытию катиона Мg2+. Отделить катион Са2+ от Mg2+ можно оксалатом аммония (NH4)2C2О4. Анализ смеси катионов второй группы проводят, используя групповой реактив.
1. Открытие катиона Ва2+. К 2 - 3 каплям исследуемого раствора добавить 1 - 2 капли раствора хромата калия K2CrO4. Выпадение кристаллического осадка желтого цвета указывает на присутствие ионов Ва2+.
2. Отделение катионов Ва2+ н Са2+ от ионов Мg2+. В пробирку прилить 2 мл исследуемого раствора, прибавить по каплям раствор гидроксида аммония NН4ОН до слабой щелочной среды, 5-6 капель раствора члорнда аммония NH4CI. Смесь нагреть на водяной бане. Затем к смеси при помешивании добавлять раствор карбоната аммония (NH4)2CO3 до тех пор, пока не прекратится выпадение осадка. Смесь нагревать в течение 8 - 10 минут. Образуется кристаллический осадок. Дать смеси отстоятся. Проверить полноту осаждения катионов Ва2+ и Са2+. Для этого осторожно, не взмучивая осадка, по стенке пробирки добавить 1 - 2 капли раствора группового реактива (NH4)2CO3. Если раствор не мутнеет, то осаждение полное. Если наблюдается помутнение раствора, то к раствору добавить 2 - 3 капли раствора (NH4)2CO3 содержимое перемешать, поместить на водяную баню и снова проверить на полноту осаждения. Добившись полного осаждения, отделить раствор от осадка фильтрованием Раствор (2) содержит катион Mg2+, а в осадке (1) ВаСО3 и СаСО3.
3. Исследование осадка (I). Осадок промыть дистиллированной водой. В воронку с осадком прилить горячей воды 11ромывную воду отбросить, а осадок растворить. К осадку добавить 8 - 10 капель 15%-ной уксусной кислоты CH3COOН и при перемешивании подогреть содержимое на водяной бане до полного растворения осадка. Если катион Ва2+ был обнаружен в предварительных испытаниях, его необходимо удалить. К полученному раствору (3) добавить 5 - 6 капель ацетата натрия CН3COONa и 5 -6 капель хромата калия К2rС4. Содержимое пробирки нагреть. Осадок от раствора отделить фильтрованием. В растворе (4) открывать катион Са2+.
4. Открытие катиона Са2+. К 2 - 3 каплям раствора (4) добавить 2 - 3 капли раствора оксалата аммония (NH4)C2O4. Выпадение осадка белого цвета указывает на присутствие катиона Са2+.
5. Открытие катиона Mg2+. К 3 - 4 каплям раствора (2) добавить 2 - 3 капли раствора хлорида аммония NH4C1. затем 3 - 5 капель гидрофосфата натрия Na2HPO4 и добавить водный раствор аммиака NН4ОН до щелочной реакции. Выпадение осадка белого цвета указывает на присутствие катиона Mg2+.
Контрольные вопросы:
1. Чем вторая аналитическая группа отличается от первой группы?
2. Какое положение в ПСХЭ занимают металлы, образующие катионы второй аналитической группы, и как это отражается на их свойствах?
3. Для чего при осаждении катионов второй группы групповым реактивом (NH4)2CO3 добавляют гилроксид аммония NH4OH и хлорид аммония NH4C1?
4. Можно ли вести открытие катиона Са2+ в присутствии катиона Ва2+? Ответ подтвердите уравнениями реакций в молекулярной и ионной формах.
5. Можно ли открыть катион Mg2+ в присутствии катионов Ва2+ и Са2+? Ответ подтвердите уравнениями реакций в молекулярной и ионной формах.
6. Для чего при открытии катиона Mg2+ добавляют 1 идроксид аммония NН4OН и хлорид аммония NH4Cl?
7. Можно ли анализ раствора, содержащего катионы второй группы, начать:
а) с открытия Mg2+ реакцией с гидрофосфатом натрия и гидроксидом аммония;
б) с открытия Ва2+ реакцией с хроматом калия;
в) с открытия Са2+ реакцией с оксалатом аммония? Ответы объясните.
8. Укажите порядок обнаружения катионов 11 группы в смеси.
Дата добавления: 2015-11-10; просмотров: 18484;
