ГЛАВА 13. D. H. Gelfand, J. P. Holland, J
D. H. Gelfand, J. P. Holland, J. H.Meade. 1985. Expression, glycosylation and secretion of an Aspergillus glucoamylase by Saccharomyces cere-visiae. Science 228: 21-26.
Kallio P-, A. Palva, I. Palva.1987. Enhancement of α-amylase production by integrating and amplifying the α-amylase gene of Bacillus amyloliquefaciens in the genome of Bacillus subtUis. Appl. Microbiol. Biotechnol. 27: 64-71.
Kennedy J. F., V. M. Cabalda, С. A. White.1988. Enzymic starch utilization and genetic engineering. Trends Biotechnol. 6: 184—189.
Knowles J., P. Lehtovaara, T. TeerL1987. Cellulase families and their genes. Trends Biotechnol. 5: 255-261.
Kolenc R. J., W.E. Inniss, B. R. Click, C. W. Robinson, C. I. Mayfield.1988. Transfer and expression of mesophilic plasmid-mediated dcgradative capacity in a psychrotrophic bacterium. Appl. Environ. Microbiol. 54: 638—641.
Kumar V., S. Riimakrishiian, T. T. Teeri, J. К. С Knowles,
B. S. Hartley.1992. Saccharomyces cerevisiae cells secreting an Aspergillus tiigcr β galactosidase grow on whey permeate. Bio/Technotogy 10: 82-85.
Lamed R., J.Nainiark, E. Morgenstern, E.A. Bayer.1987. Speciali/cd cell surface structures in cellu-lolytic bacteria. J. Bacteriol. 169: 3792-3800.
Lynd L. R., J. H.Cushman, R. J. Nichols,
C. E. Wyman. 1991. Fuel etlianol from cellulosic biomass. Science 251: 1318-1323.
Meng M., С. Lee, M.Bagdasarian, J. G. /cikus. 1991. Switching Substrate preference of ther-mophilic xylose isomerase from D-xylose to D-glucose by redesigning the substrate binding pocket. Proc. Natl. Acad. Sei. USA 88: 4015-4019.
Pérez-Gonzàles J. A., R.Gonzales, A. Querol, J.Sentira, D. Ramon.1993. Construction of a recombinant wine yeast strain expressing ß-( 1,4)-endoglucanase and its use in microvinifica-tion processes. Appl. Environ. Microbiol. 59: 2801-2806.
Quax W. J., N. T. Mrabet, R. G. M.Luiten, P. W. Schuurhuizen, P.Stanssens, I. Lasters. 1991. Enhancing the thermostabiligy of glucose isomerase by protein engineering. Bio/Technology 9: 7'38-742.
Ramos J. L·, A. Wasserfallen, K. Rose, K. N. Timmis. 1987. Redesigning metabolic routes: manipulation of TOL plasmid pathway for catabo-lism of alkyl-benzoates. Science 235: 593-596.
Suyama A., R. Iwakiri, N. Kimura, A. Nishi, K.Nakamura, K. Furukawa. 1996. Engineering hybrid pseudomonads capable of utilizing a wide range of aromatic hydrocarbons and of efficient degradation of trichloroethylene. J. Bacteriol. 178: 4039-4046.
Timmis K. N., R. J. Steffan, R. Unterman.1994. Designing microorganisms for the treatment of toxic wastes. Anna. Rev. Microbiol. 48: 525-557.
Verdoes J. C., A. D. van Diepeningen, P. J. Punt, A. J. M. Debets, A. H. Stouthamer, C. A. M. J. J.van den Hondcl. 1994. Evaluation of molecular arid genetic approaches to generate glucoamylase overproducing strains of Aspergillus niger. J. Biotechnol. ЪЬ\ 165-175.
Wayman M., S. (Сhen, K. Doan.1992. Bioconversion of waste paper to ethanol. Process Biochem. 27: 239-245.
Windass J. D.f M. J. Worsey, E. M. Pioli, D. Ptoli, P. T. Barth, K. T. Atherton, E. C. Dart, D. Byrom, K. Powell, P. J. Senior.1980. Improved conversion of methanol to single cell protein by Methyiophilus methylotrophus. Naiure2S7: 396-401.
Winter R. В., К.-М. Yen, B. D. Ensley.1989. Efficient degradation of trichloroethylene by a recombinant Escherichia coli. Bio/Technology 7: 282-285.
Witholt В.,M.-J. deSmet, J. Kingnta, J. B.van Beilen, M. Kok, R. G. Lageveen, G. Eggink.1990. Bioconversions of aliphatic compounds by Pseudomonas oleovorans in multiphase bioreac-tors: background and economic potential. Trends Eiotechiwl 8:46-52.
Wong W. K. R., C. Curry, R. S. Parekh, S. R. Parekh, M.Wayman, R. W. Davies, D. G. Kilburn,N. Skipper. 1 'JXS. Wood hydrolysis by Cellulomonas fumi endoglucanase and exoglucanase coexpressed as secreted enzymes in Saccharomyces cerevisiae. Bio/Technology 6: 713-719.
7harig M., C. Eddy, K. Deanda, M. Finkelstein, S. Picataggio.1995. Metabolic engineering of a pentose metabolism pathway in ethanologenic Zymomonas mobilts. Science 267: 240—243.
Биодеградация и утилизация биомассы 305
Zylstra G. J., L. P. Wackett, D. T.Gibson. 1989. Trichloroethylene degradation by Escherichia со/г containing the cloned Pseydomonasputida FI toluene dioxygenase genes. Appi. Environ. Microbiol. 55: 3162-3166.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как следует модифицировать P. putida, чтобы получился штамм, эффективно разрушающий трихлорэтилен?
2. Опишите процедуру клонирования целлюлазных генов грибов.
3. Как используются α-амилаза и глюкоамилаза в промышленном производстве этанола? Какие манипуляции с кодирующими эти ферменты генами следует провести, чтобы повысить эффективность процесса?
4. Что представляет собой фермент глюкозоизомераза? В чем состоит ее ценность? Как и зачем можно модифицировать кодирующий ее ген?
5. Опишите достоинства и недостатки использования Zymomonas mobilîs вместо Saccharomyces cerevisiae при производстве этанола. Как повысить эффективность промышленного использования Z. mobilis?
6. Как с помощью генноинженерных методов модифицировать Z. mobilis, чтобы можно было использовать этот микроорганизм для производства этанола из ксилозы?
7. Взяв три штамма Pseudomonas., один из которых использует фенол в качестве единственного источника углерода при 0 °С, второй расщепляет антрацен с образованием катехола при 35 °С, а третий расщепляет n-толуол с образованием протокатехоата при 35 °С, предложите стратегию создания штамма, который сможет использовать в качестве единственного источника углерода фенол, антрацен или n-толуол при О °С.
8. Как модифицировать штамм Pseudotnonas, несущий плазмиду pWWO и не способный расщеплять 4-этилбензоат, чтобы он мог утилизировать это соединение?
9. Предложите стратегии выделения прокариотических эндоглюканазных и ß-глюкозидазных генов.
10. Что такое «супербацилла»?
11. Как повысить эффективность образования силоса, проводя манипуляции с Lactobacillus plantarum?
12. Как следует модифицировать бактерии рубца, чтобы они обеспечивали крупный рогатый скот незаменимыми аминокислотами?
ГЛАВА 14.
Бактерии, стимулирующие рост растений
Скорость роста и урожайность растений в естественных условиях зависят от их генотипа, доступности питательных веществ, наличия в почве полезных микроорганизмов и отсутствия патогенных (так называемых фитопатогенов, от phyto — растение). Одни виды полезных природных почвенных бактерий и грибов оказывают прямое действие, другие опосредованное. Первые поставляют растениям соединения, стимулирующие их рост, вторые подавляют размножение патогенных почвенных микроорганизмов, предотвращая их негативное влияние на растение.
К основным механизмам стимуляции роста растений микроорганизмами «прямого действия» относятся: 1) фиксация атмосферного азота, который затем используется растением; 2) образование легко усваиваемых форм железа и фосфора и/или поглощение из почвы и доставка этих полезных минеральных веществ в растения; 3) синтез фитогормонов, вызывающих пролиферацию растительных клеток. Опосредованная стимуляция роста растения каким-либо штаммом полезного микроорганизма проявляется через предотвращение роста фитопатогенного почвенного микроорганизма, который moг бы отрицательно влиять на нормальный рост и развитие растения. Такое действие называется антибиозом и может заключаться либо в истощении полезным микроорганизмом лимитирующего субстрата, либо в синтезе и секреции соединения, препятствующего росту фитопатогена.
Последние генетические эксперименты по созданию штаммов микроорганизмов, способных более эффективно стимулировать рост растений, были направлены в основном на решение следующих четырех проблем.
• Молекулярные механизмы фиксации азота. Цель всех исследований состояла в том, чтобы оценить возможности повышения уровня фиксации азота микроорганизмами и, следовательно, снизить количество вносимых в почву химических удобрений.
• Образование корневых клубеньков симбиотическими бактериями. Целью этих исследований было создание рекомбинантных бактерий, способных конкурировать с природными симбиотическими бактериями.
• Микробиологический синтез веществ, хелатирующих железо (сидерофоров). Есть надежда, что удастся получить штаммы микроорганизмов, подавляющие рост фитопатогенов.
• Микробиологический синтез фитогормонов. Эти исследования проводились для того, чтобы создать штаммы бактерий, синтезирующие и секретирующие определенные количества фитогормонов, которые ускоряли бы рост растений.
Исследования в этой области проводятся главным образом на бактериях, а не на грибах. Отчасти это обусловлено тем, что полезные грибы не удается вырастить в культуре, поэтому с ними трудно работать в лабораторных условиях, а кроме того, невозможно получить эти организмы в количестве, достаточном для инокуляции.
Фиксация азота
Азот (N2) — газ, на долю которого приходится примерно 80% (по объему) воздуха, которым мы дышим. Растения или животные не могут использовать его непосредственно для синтеза не-
Бактерии, стимулирующие рост растений 307
обходимых им биологических азотсодержащих соединений типа аминокислот и нуклеотидов; предварительно азот должен быть включен в состав аммиака (фиксирован). Это требует больших энергетических затрат, поскольку тройная связь в молекуле N2 (N = N), которую необходимо предварительно разорвать, чрезвычайно прочная. Энергия для биологической фиксации азота высвобождается при гидролизе больших количеств аденозинтрифосфата (АТР). Для химического (промышленного) превращения N2 в аммиак используют высокие температуру и давление.
Для удовлетворения потребностей пищевой промышленности в сельскохозяйственной продукции ежегодно требуется более 100 млн. т связанного азота. Примерно половину этого количества составляют синтетические (химически синтезированные) удобрения, а большую часть второй половины растения получают от азотфиксирующих (диазотрофных) бактерий типа Rhizobium, Frankia, Azospirillum, Azotobacfer и цианобактерий. Ни один из эукариотических организмов не способен связывать азот.
Благодаря применению химических удобрений удалось значительно повысить урожайность сельскохозяйственных культур, однако их продолжительное использование приводит к загрязнению почвы и истощению запасов в ней питательных веществ. К тому же химические удобрения становятся все более дорогими. Все это стимулировало поиск альтернативных источников связанного азота, в частности создание штаммов диазотрофных микроорганизмов, которые могли бы служить «бактериальными удобрениями».
Способностью к фиксации азота обладают самые разные бактерии, и многие из них в принципе могут использоваться как удобрения. Однако до тех пор, пока не будет показано, что бактериальные удобрения столь же эффективны, как и химические, вряд ли удастся преодолеть консерватизм производителей сельскохозяйственной продукции и изменить используемые в настоящее время подходы. Например, вторая по экономической значимости и по занимаемым площадям сельскохозяйственная культура в США — соя — формирует симбиотические отношения с бактерией Bradyrhizobium japonicum. B результате такого симбиоза бактерии обеспечивают растение связанным азотом, а сами получают от него легко усваиваемые формы углерода, образующиеся при фотосинтезе. После инокуляции растений некоторыми штаммами В. japonicum конечный выход растительной биомассы может возрасти на 25—50% и никаких добавок химически связанного азота больше не потребуется. Примерно 50% сои выращивается в нескольких регионах США, при этом везде используется в общем сходная технология. Но лишь небольшую часть этой культуры в настоящее время обрабатывают В. japonicum. Фермеры до сих пор полагаются на природные штаммы В. japonicum и химические удобрения.
Репутация бактериальных удобрений весьма сомнительна. В 1950-х годах в СССР более 10 млн. га сельскохозяйственных угодий обрабатывались смесью диазотрофных бактерий, состоящей в основном из Azotobacter chroococcum и Bacillus megaterium. При этом примерно в 60% случаев урожайность различных зерновых повысилась на 10—20%. Однако эти полевые испытания оказались некорректными и невоспроизводимыми; многие исследователи выразили сомнения в правильности полученных результатов, и использование бактериальных инокулятов в качестве удобрений не получило развития. Однако проблемы экономического характера, необходимость предотвращения загрязнения окружающей среды, появление новых технологий привели к тому, что ученые вновь обратились к изучению возможности использования бактериальных удобрений.
Микроорганизмы, которые применяются в настоящее время в сельском хозяйстве, принадлежат в основном к двум родам: Rhizobium и Bradyrhizobîum. Это грамотрицательные палочкообразные жгутиковые бактерии, находящиеся в симбиозе с бобовыми. Каждый вид Rhizobium и Bradyrhizobîum специфичен в отношении лишь небольшого числа видов растений и не взаимодействует с растениями, не являющимися его природными хозяевами (табл. 14.1).
На определенной стадии жизненного цикла Rhizobium проникает в клетки корня растения и инициирует комплекс изменений, приводящих к формированию корневого клубенька. Бактерии внутри корневого клубенька быстро проли-
308 ГЛАВА 14
| Таблица 14, 1, Специфичность видов Rhizobium и Bradyrhizobium в отношении разных растений | |
| Бактерия | Растение-хозяин |
| Bradyrhizobium japonicum | Соя |
| Rhizobium meliloti | Люцерна |
| Rhizobium leguminosarum bv, trifolii | Клевер |
| Rhizobium leguminosarum bv. viciae | Горох, фасоль |
| Rhizobium leguminosarum | Фасоль обыкновенная, |
| bv, phaseoli | фасоль золотистая |
| Rhizobium loti | Лотос |
| Rhizpbium huakuii | Astragalus sinicus |
| Rhizobium ciceri | Турецкий горох |
| Rhizobium tropici | Leucaena spp., Macroptilium spp. |
| Rhizobium galegne | Galega officinalis. G. orientalis |
| Rhizobium fredii | Соя |
| Rhizobium sp. штамм NGR 234 | Тропические бобовые |
| Rhizobium elti | Фасоль обыкновенная, фасоль золотистая |
| Bradyrhizobium elkanii | Соя |
ферируют и находятся в форме, не имеющей клеточной стенки. Клубеньковые бактерии связывают атмосферный азот с помощью фермента нитрогеназы. Структурные и биохимические взаимодействия между симбионтами - Rhizobium и растением-хозяином — весьма сложны и взаимовыгодны. Внутри клубенька нитрогеназа защищена от токсического действия атмосферного кислорода двумя способами. Во-первых, кислород практически не проникает в клубенек. Во-вторых, содержание кислорода внутри клубенька регулируется белком леггемоглобином. Гемовый компонент этого кислородсвязываюшего белка синтезируется бактерией, а глобиновая часть молекулы кодируется геномом растения. Растение обеспечивает бактерии необходимыми для роста связанными формами углерода, образующимися при фотосинтезе, а растение извлекает выгоду из этих симбиотических отношений, получая от бактерии связанный азот.
Нитрогеназа
Интерес к диазатрофам как к биологическим удобрениям возродился после того, как были разработаны методы выделения и модификации генов, и это стимулировало изучение биохимических и молекулярно-биологических механизмов фиксации азота. Ученые надеялись, что благодаря этим исследованиям удастся создать более эффективные азотфиксирующие микроорганизмы, способствующие повышению урожайности сельскохозяйственных культур, а некоторые исследователи лаже предполагали ввести бактериальные гены фиксации азота непосредственно в растения, чтобы такие растения могли сами фиксировать азот. И хотя эти чересчур смелые планы не удалось осуществить, процесс фиксации азота был детально изучен, так что возможность генноинженерного усовершенствования некоторых диазотрофов стала более реальной.
Компоненты
Все известные нитрогеназы содержат два кисло-родчувствительных компонента: I и 11. Компонент 1 — это комплекс из двух а-субъединиц (массой примерно 50 000 Да каждая), двух β-субъединиц (примерно 60 000 Да каждая), 24 молекул железа, двух молекул молибдена и железо-молибденового кофактора, обозначаемого FeMoCo (рис. 14.1). Компонент II состоит из двух α-субъединиц (примерно 32 000 Да каждая) и из неизвестного числа молекул железа, причем его α-субьединицы не аналогичны таковым в компоненте 1. Для фиксации азота необходимы оба компонента, комплекс магния и ATP, a также источник восстановительных эквивалентов:
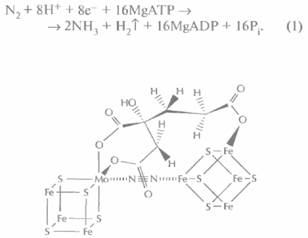
|
| Рис. 14.1. Предполагаемая структура железомолибденового кофактора, связанного с молекулой азота (N2). |
Бактерии, стимулирующие рострастений 309
Помимо фиксации азота, нитрогеназа катализирует также восстановление газообразного ацетилена до этилена:
Н-С≡С-Н + 2Н+ --> Н2=С=С=Н2. (2)
Определяя с помощью газовой хроматографии количество синтезированного этилена, можно оценивать активность нитрогеназы. Определения можно проводить на целых клетках в растворе (рис. 14.2), на бактериях, ассо-
циированных с корнями растений, на грубых экстрактах клеток или на высокоочищенных препаратах фермента. Компонент I катализирует собственно восстановление N2, a компонент 11 служит донором электронов. Оба они чрезвычайно чувствительны к кислороду и при слишком высоких его концентрациях быстро и необратимо инактивируются. Функционирование нитрогеназы зависит также от 15—20 вспомогательных белков. Роль некоторых из них состоит в передаче электронов
| Рис. 14.2. Определение активности нитрогеназы по восстановлению ацетилена до этилена. А, Бактерии (в культуре или ассоциированные с корнями растения), синтезирующие нитрогеназу, либо препарат очищенного фермента (не показано) помещают в герметичную емкость в атмосферу ацетилена. Б. Из емкости периодически отбирают пробы и методом газовой хроматографии измеряют количество ацетилена и этилена. Активность нитрогеназы пропорциональна количеству образовавшегося этилена. | 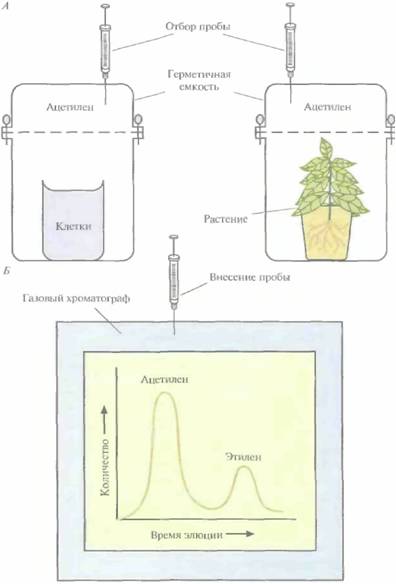
|
Дата добавления: 2015-07-14; просмотров: 677;
