ГЛАВА 8.

|
| Рис. 8.4. Олигонуклеотид-направленный мутагенез с использованием ПЦР. Реакцию проводят в двух пробирках, в каждой из которых содержится одинаковая двухце π очечная плазмидная ДНК, но разные наборы праймеров. Πраймеры 1 и 3 содержат один неспаривающийся нуклеотид и комплементарны разным цепям плазмидной ДНК. Праймеры 2 и 4 полностью комплементарны соответствующим участкам плазмидной ДНК и тоже гибридизуются с разными цепями. Положение сайтов гибридизации для праймеров каждой пары различается, но их концы стыкуются. В результате ПЦР-амплификации образуются линейные молекулы. По окончании реакции содержимое пробирок смешивают и проводят денатурацию, а затем ренатурацию. В результате кроме двух исходных линейных амплифицированных молекул образуются две кольцевые плазмидные ДНК, каждая с двумя одноцепочечными разрывами. После трансформации кольцевыми молекулами клеток Е. coli разрывы репарируются ферментами клетки-хозяина, и плазмида может реплицироваться независимо. Линейные молекулы ДН К в E. coli не сохраняются. |
Направленный мутагенез и генная инженерия белков 165

|
| Олигонуклеотид-направленный мутагенез с использованием векторов на основе фага M 13: эффективный универсальный метод внесения точковых мутаций в любой фрагмент ДНК M.J. Zoller, M.Smith Nucleic Acids Rea, .10: 6487-6500. 1982 |
| Методика олигонуклеотид-направленного мутагенеза (сайт-специфического мутагенеза) была разработана в основном в лаборатории М, Смита как модификация метода «спасения маркера». При «спасении маркера» мутацию в фаговой ДНК устраняют с помощью отжига мутантной ДНК с фрагментом комплементарной ДНК дикого типа. Было показано, что, отжигая химически синтезированный олигонуклеотид с фаговой ДНК, можно, напротив. | вносить в нее мутации. К сожалению, этот и другие методы олигонуклеотид-направленного мутагенеза требовали для своего применения специальных навыков и вначале применялись только в нескольких научно-исследовательских лабораториях. Подход, разработанный Цоллером и Смитом, позволял относительно просто, специфично и быстро вносить мутации в любой клонированный ген и сразу же получил широкое распространение. В | его основе лежит использование фага М13 E соli. Чужеродную ДНК встраивают в двухцепочечную репликативную форму фаговой ДНК, к одноцепочечной ДНК добавляют олигонуклеотид с необходимыми заменами, получают мутантную копию ДНК. а затем мутантную двухцепочечную форму. Впоследствии эта методика была существен но усовершенствована и упрощена и использовалась для направленного мутагенеза тысяч разных генов. |
Частично вырожденные олигонуклеотиды могут быть встроены в ген-мишень разными способами. Один из подходов состоит в следующем. Ген встраивают в плазмиду между двумя уникальными сайтами рестрикции и проводят амплификацию его
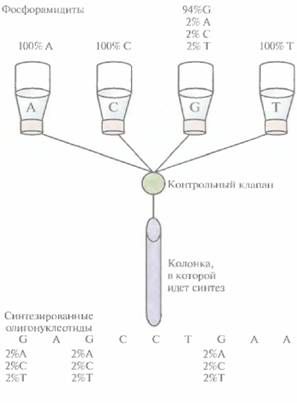
| Рис. 8.5. Химический синтез олигонуклеотидных праймеров. содержащих в определенных сайтах разные нуклеотиды. В данном случае в сосуде с С-фосфорамидитом (94%) содержатся также фосфорамидиты А (2%), С (2%) и Т (2%), так что в результате реакции образуется смесь олигонуклеотидов, в которых в тех сайтах, где должен находиться С, присутствуют А, С или Т. |
левого и правого перекрывающихся между собой фрагментов при помощи нескольких ПЦР (рис. 8.6). Пара праймеров, которая используется для амплификации левого фрагмента, включает неполностью комплементарный олигонуклеотид, спаривающийся с тяжелой цепью гена-мишени, и обычный, полностью комплементарный праймер, гибридизующийся с участком легкой цепи, фланкирующим левый уникальный сайт рестрикции. Один из праймеров, использующихся для амплификации правого фрагмента, содержит некомплементарные нуклеотиды и спаривается с тяжелой цепью гена-мишени, а второй праймер полностью комплементарен участку легкой цепи, фланкирующему второй (правый) уникальный сайт рестрикции. Продукты ПЦР-амплификации очищают и объединяют, а затем подвергают денатурации и ренатурации. В результате образуется некоторое количество частично двухцепочечных молекул ДНК, спаренных в области гена-мишени. Их достраивают до полностью двухцепочечных с помощью ДНК-полимеразы, а затем проводят ПЦР-амплификацию с парой праймеров, комплементарных противо-
166 ГЛАВА 8
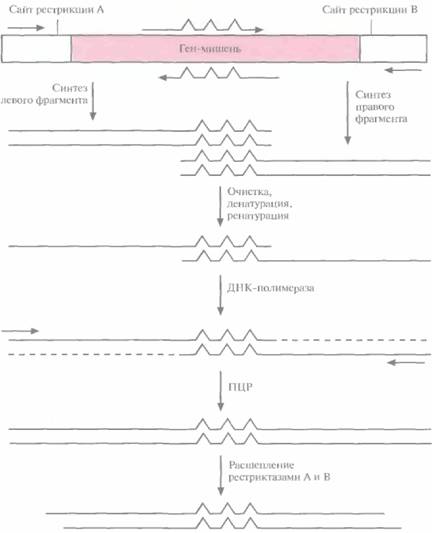
| Рис. 8.6. Случайный мутагенез с использованием «вырожденных» олигонуклеотидов и ПЦР. Левую и правую части гена-мишени амплифициру-ют по отдельности с помощью ПЦР, Соответствующие праймеры показаны горизонтальными стрелками. «Вырожденные» олигонуклеотиды изображены стрелками с тремя зазубринами, каждая из которых отвечает нуклеотиду, не комплементарному соответствующему нуклеотиду в гене-мишени, Амплифицированные фрагменты очищают, денатурируют до полного разделения цепей и ренатури-руют. В результате образуются частично двух цеп очечные молекулы ДНК, спаренные в области гена-мишени. Их достраивают с помошью ДНК-полимеразы и проводят ПЦР-амплификацию. ПЦР-продукты расщепляют эндонуклеазами рестрикции А и В и встраивают в вектор, обработанный теми же ферментами. |
положным концам молекул. Амплифицированные молекулы обрабатывают двумя эндонуклеазами рестрикции, уникальные сайты которых находятся на концах фрагмента, и встраивают в соответствующий плазмидный вектор. Этот подход позволяет получить измененные гены со случайными мутациями.
Случайный мутагенез с использованием аналогов нуклеотидов
Помимо методов внесения мутаций в клонированный ген, основанных на использовании фага М13, были разработаны другие подходы, в
которых использовались плазмидные ДНК, Один из них схематично представлен на рис. 8.7. Ген-мишень встраивают в плазмиду поблизости от двух тесно расположенных сайтов рестрикции. Эти сайты подбирают так, чтобы после расщепления двумя рестриктазами образовывались укороченные 3'- и 5'-концы, а именно, чтобы 3'-конец сайта расщепления, расположенного рядом с клонированным геном, был укорочен, а 3'-конец с другой стороны плазмиды выступал.
Экзонуклеаза III (ExoIII) E. coli расщепляет молекулу ДНК только с укороченных 3'-концов,
Направленныймутагенез и генная инженерия белков 167
но не с выступающих 3'- или любых 5'-концов. Ее добавляют в реакционную смесь после инкубированния ДНК с двумя рестриктазами, и она отщепляет от укороченного 3'-конца цепи по одному нуклеотиду. Через определенное время реакцию останавливают и заполняют пробел с помощью фрагмента Кленова ДНК-полимеразы I, используя смесь обычных четырех дезоксирибонуклеотидов с добавлением аналога одного из них. В результате получают плазмиды, содержащие ген-мишень, в одном или нескольких сайтах которого находится аналог соответствующего нуклеотида. Ими трансформируют клетки Е. coli. Плазмиды реплицируются, и в клонированный ген включается нуклеотид, отличный от такового в исходном гене.
Помимо описанного выше, для случайного мутагенеза используют и другие методы, например один из вариантов олигонуклеотид-направленного мутагенеза с применением ДНК фага M13. В этом случае затравкой для синтеза ДНК служит смесь олигонуклеотидов, содержащих случайные замены. В результате получают библиотеки клонов, несущих множество мутаций в различных сайтах. Недостаток подходов, при которых в клонированном гене образуется большое число случайных мутаций, состоит в необходимости тестирования каждого клона для идентификации того, который детерминировал бы синтез нужного белка. Это весьма непростая

| Рис.8.7. Внесение случайных мутаций в клонированный ген. Вектор, несущий клонированный ген, расщепляют рестриктазами RE1 и RE2, в результате чего образуются один 3'- и один 5'-укороченные концы (и соответственно один 3'- и один 3’-выступающие концы). Затем его обрабатывают ферментом ExoIIl, который расщепляет ДНК только с укороченного 3'-конца, удаляя по одному нуклеотиду. Через некоторое время реакцию останавливают и заполняют образовавшийся пробел с помощью фрагмента Кленова ДНК-полимеразы I E. coli. При этом в реакционную смесь добавляют все четыре дезоксинуклеозидтрифосфата (dNTP) и в небольшом количестве - аналог одного из них. Обрабатывают продукт нуклеазой S1 для образования тупых концов, лигируют с помощью ДНК-лигазы и трансформируют клетки Ε. coll. При последующей репликации векторной ДНК в комплементарную цепь включаются нуклеотиды, отличные от исходных, в том сайте, где находится аналог нуклеотида. В результате в клонированный ген вносится мутация. |
Дата добавления: 2015-07-14; просмотров: 1362;
