ГЛАВА 6
| Таблица 6.6. Влияние числа копий плазмиды на скорость роста хозяйских клеток1) | ||
| Плазмиды, присутствующие в клетках Е. coli НВ1012) | Число копий плазмиды | Относительная скорость роста |
| Плазмида отсутствует | 1,00 | |
| А | 12 | 0,92 |
| B | 0,91 | |
| C | 0,87 | |
| D | 0,82 | |
| E | 0,77 | |
| 1) По данным работы Seo, Bailey. 1985. Biotechnol. Bioeng. 27: 1668- 1674. 2) Плазмиды, обозначенные буквами А, В, С, D и E, кодируют только ß-лактамазу и имеют одинаковый размер. |
Поскольку клеткам, растущим в условиях метаболической перегрузки, не хватает энергии для нормального функционирования, затрагиваются прежде всего такие энергоемкие метаболические процессы, как фиксация азота или синтез белков. Могут изменяться также размер и форма клеток, образовываться слишком много внеклеточного полисахарида, склеивающего клетки друг с другом и затрудняющего микрофильтрацию.
Как следствие метаболической перегрузки, обусловленной образованием избыточного количества чужеродного белка и нехваткой питательных веществ или «строительных блоков» -аминокислот, может произойти запуск стрессовых механизмов, в частности инициироваться синтез клеточных протеиназ, под действием которых произойдет быстрая деградация рекомбинантного белка. Истощение пула аминокислот может стать результатом эффективной экспрессии не только клонированных генов-мишеней, но и генов самого вектора, кодирующих маркеры устойчивости к антибиотикам.
Вероятность трансляционных ошибок для E. coli составляет 2·10~4—2·10~3 на 1 клетку за генерацию. Однако в условиях нехватки определенных аминоацил-тРНК, что часто случается при суперпродукции чужеродных белков, вероятность включения в белковую молекулу неправильной аминокислоты вместо недостающей сильно увеличивается. Кроме того, точность трансляции еше больше снижается из-за недостатка GTP, который является необходимым компонентом корректирующего аппарата. В одной из работ было показано, что в условиях гиперпродукции фактора роста эпидермиса мыши в клетках E. coli частота ошибочных включений аминокислот в рекомбинантный белок увеличивается в 10 раз. Это не позволяет использовать синтезируемый белок в качестве лекарственного средства, поскольку: 1) удельная активность и стабильность белка могут быть гораздо ниже ожидаемых; 2) наличие в молекуле «неправильных» аминокислот может вызвать нежелательную иммунологическую реакцию при введении такого белка в организм человека.
К счастью, правильно спланировав эксперимент, можно минимизировать влияние метаболической перегрузки, оптимизировать выход рекомбинантного белка и повысить стабильность трансформированных хозяйских клеток. Например, нагрузку можно снизить, если использовать малокопийные плазмидные векторы. А еще лучше вообще отказаться от векторов и встроить чужеродную ДНК в хромосомную ДНК организма-хозяина. В этом случае не нужно заботиться об обеспечении стабильности плазмиды. Кроме того, клетке не приходится расходовать свои ресурсы на синтез ненужных продуктов, кодируемых маркерными генами устойчивости к антибиотикам. Синтез продуктов таких генов, входящих в состав плазмидных векторов наряду с генами-мишенями, является одной из основных причин метаболической перегрузки. Интеграция в хромосому особенно важна в тех случаях, когда используется сам рекомбинантный микроорганизм, а не синтезируемый им продукт. Уменьшению метаболической перегрузки помогает также применение сильных, но регулируемых промоторов, В такте случаях ферментацию проводят в две стадии. На первой из них, во время роста, промотор, контролирующий транскрипцию гена-мишени, выключен, а на второй, во время индукции, -включен.
Оптимизация экспрессии генов, клонированных в прокариотических системах 129
Если частота использования кодонов у чужеродного гена отличается от таковой у организма-хозяина, то проблему нехватки специфических аминоацил-тРНК можно решить, синтезировав часть гена-мишени или даже весь ген с более близким к хозяйскому организму набором кодонов. Так, в одном из исследований было показано, что количество стрептавидина, образующегося при экспрессии синтетического гена с GС-содержанием 54%, было в 10 раз больше, чем при экспрессии «природного» гена с GC-содержанием 69%, Однако этот подход довольно сложен и может применяться лишь в редких случаях.
Как это ни парадоксально, но один из способов увеличения количества чужеродного белка, синтезируемого рекомбинантным микроорганизмом, состоит в поддержании уровня экспрессии его гена на среднем уровне (так, чтобы на долю продукта приходилось примерно 5% суммарного клеточного белка), но зато в максимальном увеличении плотности культуры. Микробиологическая система с 5%-ным уровнем экспрессии чужеродного белка и низкой метаболической нагрузкой, в которой плотность может достигать 40 г/л (масса сухого вещества), оказывается более эффективной, чем система с 15%-ным уровнем экспрессии и плотностью 10 г/л.
Достичь одновременно и высокого уровня синтеза чужеродного белка, и высокой плотности культуры часто не удается из-за накопления вредных побочных продуктов (в первую очередь ацетата), подавляющих рост клеток и синтез белка. Чтобы уменьшить накопление ацетата в богатой среде, не нарушая роста клеток, можно снизить скорость поглощения глюкозы, добавив в среду ее аналог, метил-α-гликозид. Альтернативный подход состоит в использовании клеток Е. coli, несущих мутацию в гене рtsG, который кодирует фермент II глюкозофосфотрансферазной системы. Максимальная плотность культуры Е. coli дикого типа составила примерно 10 г/л, а культуры E. coli с мутацией в гене ptsG — 15 г/л. Кроме того, уровень синтеза ß-лактамазы в мутантных клетках был на 25% выше (на 1 г массы сухого вещества), чем в клетках дикого типа, так что суммарное различие достигает примерно двукратной величины.
Достичь аналогичного результата можно гораздо проще и быстрее, если использовать методы генной инженерии, а не мутагенез и отбор. Один из подходов состоял во введении в E. coli
| Рис. 6.17. Схематическое представление метаболизма глюкозы в клетках E. coli, трансформированных плазмидой, несущей гены ацетолактатсинтазы. | 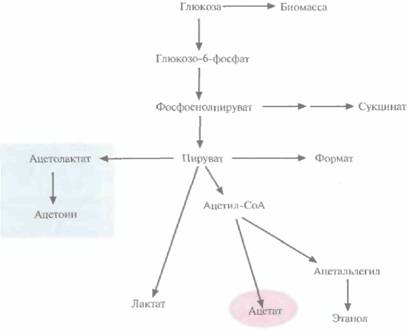
|
130 ГЛАВА 6
генов, кодирующих ацетолактатсинтазу. Этот фермент катализирует образование ацетолактата из пирувата, что приводит к уменьшению количества образующегося ацетата (рис. 6.17). Гены ацетолактатсинтазы вводят в клетки в составе одной плазмиды, а гены-мишени — в составе другой, из другой группы несовместимости. Трансформированные клетки синтезируют гораздо меньше ацетата, чем нетрансформированные; вместо него образуется ацетоин, соединение примерно в 50 раз менее токсичное, чем ацетат.
ЗАКЛЮЧЕНИЕ
Чтобы получить какой-то белковый продукт, необходимо обеспечить правильную транскрипцию кодирующего его гена и трансляцию соответствующей мРНК. Для инициации транскрипции в нужном сайте необходим промотор, а для ее остановки - терминирующий кодон. Клонированный ген часто бывает лишен таких сигнальных последовательностей, и для его экспрессии в прокариотической клетке-хозяине нужно обеспечить и то, и другое. Кроме того, поскольку для решения большинства биотехнологических задач белок должен образовываться в больших количествах, необходимо использовать промотор, который позволял бы получить высокий уровень транскрипции (сильный промотор) и распознавался РНК-полимеразой хозяйской клетки. Постоянная транскрипция клонированного гена истощает энергетические ресурсы хозяйской клетки, поэтому нужно использовать промоторы, работу которых можно регулировать либо с помощью специфических низкомолекулярных соединений, либо изменением температуры.
Эффективность синтеза белка зависит от наличия в его мРНК специфических нуклеотидных последовательностей. Чтобы предотвратить разрушение белкового продукта или обеспечить его секрецию, клонированные гены, которые кодируют этот белок, подвергают направленным изменениям. Это может быть присоединение сайта связывания рибосомы перед сайтом инициации транскрипции (который в свою очередь тоже бывает нужно присоединить) или добавление к концу клонированного гена терминирующего кодона, который обеспечивал бы остановку трансляции. Если нужно, чтобы белок секретировался, то перед клонированным геном необходимо встроить сигнальную последовательность, рамка считывания которой согласуется с таковой гена-мишени.
Еще одна проблема — невысокая стабильность белков, кодируемых клонированными генами, Рекомбинантный белок может расщепляться про-теиназами хозяйской клетки. Чтобы избежать этого, можно изменить клонированный ген таким образом, чтобы на N-конце белковой молекулы оказались одна или несколько дополнительных аминокислот. В такой форме рекомбинантный белок уже не подвергается столь быстрой деградации. Кроме того, «лишние» аминокислоты иногда помогают в последующей очистке химерного белка, например с помощью иммуноаффинной хроматографии на колонке. При этом место соединения компонент подбирается так, чтобы по нему можно было расщепить молекулу (химическим или ферментативным путем) и получить эти компоненты в чистом виде.
Большинство микроорганизмов, с помощью которых получают белковые продукты, растут только в присутствии кислорода. Последний плохо растворяется в воде, и при интенсивном росте его запасы быстро истощаются. Чтобы обойти эту трудность, использовали два пути: 1) применяли штаммы, неспособные синтезировать некоторые протеолитические ферменты; 2) включали в геном хозяйских клеток гены, кодирующие гемоглобин Vitreoscilla sp., который связывает кислород окружающей среды и повышает его концентрацию в клетке.
С увеличением числа копий клонированного гена увеличивается количество синтезируемого продукта. Однако при переходе к крупномасштабному производству конструкция «плазмида/клонированная ДНК» очень часто утрачивается. Чтобы избежать этого, разработали способы интеграции клонированного гена в хромосому организма-хозяина. В этом случае ген остается в клетке как часть хозяйской ДНК.
Введение в геном организма-хозяина и экспрессия чужеродной ДНК часто приводят к нарушению его метаболизма и нормального функционирования — так называемой метаболической
Оптимизация экспрессии генов, клонированных в прокариотических системах 131
перегрузке. Разработан целый ряд способов, позволяющих минимизировать этот эффект и одновременно оптимизировать выход белка-мишени и стабильность трансформированных клеток.
Системы экспрессии весьма разнообразны, и исследователям приходится каждый раз подбирать условия, наиболее подходящие для получения того или иного белка в том или ином организме-хозяине. И все же, несмотря на различия в деталях, для создания самых разных систем экспрессии используются одни и те же основные приемы.
ЛИТЕРАТУРА
Ашапл E., J. Brosius.1985. "ATG vectors" for regulated high-level expression of clones genes in Escherichia coll. Gene A»: 183-190.
Aristidou A. A., K. Y. San, G.N. Bennett.1995. Metabolic engineering of Escherichia coli to enhance recombinant protein production through acetate reduction. Biotechnol Prog. II:475—478.
BachniairA., D, Finley, A. Varshavsky.1986. In vivo half-life of a protein in a function of its arnino-termimit residue. Science 234: 179—186.
Bagdasarian M. M., E. Amann, R. Lurz, B. Ruckert,M. Bagdasarian. 1983. Activity of the hybrid Op-lac (tac) promoter of Escherichia coli in Pseudomonas putida. Construction of broad-host-range, controlled-expression vectors, Gene 26: 273-282.
Baker R. T., A. Varshavsky.1991. Inhibition of the N-end rule pathway in living cells. Proc. Naît. Acad. Set. Î/&488: 1090-1094.
Chaitan K., J. E. Curtis, J. De Modena, U. Rinas, J. E. Bailey.1990. Expression of intracellular hemoglobin improves protein synthesis in oxygen-limited Escherichia coli. Bio/Technology 8: 849-853.
Chou С. H., G.N. Bennett, K. V.San. 1994. Effect of modified glucose uptake using genetic engineering techniques on high-level recombinant protein production in Escherichia coli dense cultures. Biotechnol. Bioeng. 44: 952-960.
deBoer H. A., L J. Cnmstnck, M. Yasser.1983. The tac promoter a functional hybrid derived from the trp and lac promoters. Proc. Nafl. Acad. Set. USA 80: 21-25.
Donovan R. S., C. W. Robinson, B. R. Click.1996. Optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter. /. Ind. Microbiol. 16: 145-154.
Ernst J. F.1988. Codon usage and gene expression. Trends Biotechnol. 6: 196-199.
Friesen J. D., G.An. 1983. Expression vehicles used in recombinant DNA technology. Biotechnol. Adv. 1: 205-227.
Geisow M. J.1991. Both bane and blessing-inclusion bodies. Trends Biotechnol. 9: 368-369.
Gentz R., A.Langner, A. C. Y. Chang, S. N. Cohen, fL Bujard.1981. Cloning and analysis of strong promoters is made possible by the downstream placement of a RNA termination signal, Proc. Natl. Acad. Sei. USA 78: 4936-4940.
Click B. R.1995. Metabolic load and heterologous gene expression. Biotechnol. Adv. 13: 247—261,
Click B. R., G. K. Whitney.1987. Factors affecting the expression of foreign proteins in Escherichia coli. J. Ind. Microbiol. I: 277-282.
Goldstein M. A., R. H. Doi.1995. Prokaryotic promoters in biotechnology, In p. 105—128. M. R. El-Gewely (ed.), Biotechnology Annual Review, vol. 1. Elsevier Science B. V., Amsterdam, The Nertherlands.
Gwynne D. I., F. P. Buxton, S. A. Williams, S. Garven, R. W. Davies.1987. Genetically engineered secretion of active human interferon and a bacterial endoglucanase from Aspergillus nidu-ians. Bio/Technology 5: 713-719.
Halfmann G., H. Brailly, A. Bernadac, F. A. Mon-tero-Julian, C. Lazdimski, D. Baty.1993. Targeting of interleukin-2 to the periplasm of Escherichia coli. J. Gen. Microbiol. 139: 2465-2473.
Hartley J. L., T. J. Gregori.1981. Cloning multiple copies of a DNA gene. Geve 13: 347-353.
Hockney R.C. 1994. Recent developments in heterologous protein production in Escherichia coli. Trends Biotechnol. 12:456-463.
Hopp T. P., K. S. Pricket t, V. L. Price, R. T. Libby, C. J. March, D. P. Cerretti, D. L. Urdal, P. J. Conlon.1988. A short polypeptide marker sequence useful for recombinant protein identification and purification. Bio/Technology 6: 1204-1210.
Hsiung H. M., A. Cantrell, J. Luirink, B. Oudega, A. J. Veros, G. W. Becker1989. Use of bacteri-
132 ГЛАВА 6
ocin release protein in E. coll for excretion of human growth hormone into the culture medium. Bio/Technology 7: 267-271.
Jay G., G. Khoury, A. K. Seth, E. Jay.1981. Construction of a general vector for efficient expression of mammalian proteins to bacteria: use of a synthetic ribosome binding site. Proc. Natl. Acad. Sei. USA 78: 5543-5548.
Jespers L. S., J. H. Messens,A. De Keyset. D. Lee kin »tit, 1. Van den Brande, Y. (i. (Îansemaiis. M. J. Lauwereys, G. P. Vlasuk, P. E. Stanssens.1995. Surface expression and ligand-based sélection of cDNAs fused to filamentous phage gene VI.Bio/Technology 13:378-382.
Kaffio P., A. Palva, I. Palva.1987. Enhancement of α-amylase production by integrating and amplifying the α-amylase gene of Bacillus amylotique-faciens in the genome of Bacillus subtilis. Appt. Microbiol. Biotechnol 27: 64-71.
Kiel J. A. K. W., A. M. ten Berge, P. Borger, G. Venema.1995. A general method for the consecutive integration of single copies of a heterol-ogous gene at multiple locations in the Bacillus subtilis chromosome by replacement recombination. Appf. Environ. Microbiol. 61:4244—4250.
Kolata G.1986. New rule proposed for protein degradation. Science234: 151—153.
Kolowsky K.S., J. G. K.Williams, A. A. Szalay. 1984. Length of foreign DNA in chimeric plas-mids determines the efficiency of its integration into the chromosome of the cyanobacterium Synechococcus R2. Gene 27: 289-299.
Kozlowski M., A. VanBrunschot, G. Nash, R. W. Davies.1988. A novel vector allowing the expression of genes in a wide range of gram-negative bacteria. Gene 70: 199-204.
Labes M., A. Puhler, R. Simon.1990. A new family of RSFlOlO-derived expression and /йс-fusion broad-host-range vectors for gram-negative bacteria. Gene 89: 37-46.
Lee N., J. Cozzitorto, N. Wainwright, D. Testa.1984. Cloning with tandem gene system for high level gene expression. Nucleic Acids Res. 12:6797-6812.
Leemans R., E. Remaut, W. Fiers.1987. Broad-host-range expression vector based on the pL promoter of соliphage 1: regulated synthesis of human interleukin 2 in Erwinia and Serratia species. J. Bacterioi. 169: 1899-1904.
Little M., F. Breitling, B. Micheel, S. Dübel.1994. Surface display of antibodies, Biotechnol. Adv. 12: 539-555.
Liu S. C., D. A. Webster, M. L. Wei, В. С.Stark. 1996. Genetic engineering to contain the Vitreoscilla hemoglobin gene enhances degradation of be n zoic acid by Xanthomonas maltophilia. Biotechnol. Bioeng. 49: 101-105.
Looman A. C., J. Bodlaender, M. de Gruyter, A.Vogelaar, P. H. van Knippenberg. 1986. Secondary structure as primary determinant of the efficiency of ribosomal binding sites in Escherichia coii. Nucleic Acids Res. 14: 5481-5497.
Magnolo S. K., D. L. Leenutaphong, J.A. DeMu-dena, J. E. Curtis, J. E. Bailey, J. L.Gala//«, D.E. Hughes.1991. Actinorhodin production by Streptomyces coeticoior and growth of Streptomyces lividans are improved by the expression of a bacterial hemoglobin. Bio/Technology 9: 473-476.
Meerman H. J., G. Georgiou.1994. Construction and characterization of a set of E, coli strains deficient in all known loci affecting the prote-olytic stability of secreted recombinant proteins. Bio/Technology 12: 1107-1110.
Miescliendahl M., B. Miiller-HUl.1985. F'-coded, temperature -sensitive λ cI857 represser gene for each construction and regulation of λ promoter-dependent expression systems. J. Bacterioi. 164: 1366-1369.
Mieschendahl M., T. Pétris, U. Hanggi.1986. A novel prophage independent trp regulated XpL expression system. Bio/Technology 4: 802-808.
Murby M., M. Üblen, S. Stähl.1996. Upstream strategies to minimize proteolytic degradation upon recombinant production in Escherichia coii. Protein Expr. Purif. 7: 129-136.
Nagai K., H. C. Thogersen, 1984, Construction of ß-globin by sequence-specific proteolysis of a hybrid protein produced in Escherichia coii. Nature 309:810-812.
Nygren P. Λ., S. Stahl, M. Uhlén.1994. Engineering proteins to facilitate bioprocessing. Trends Biotechnol. 12;184-188.
O'Neil К. Т., R H. Hoess.1995. Phage display: protein engineering by directed evolution. Curr, Opin. Struct. Biol. 5: 443-449.
Оптимизация экспрессии генов, клонированных в прокариотических системах 133
Perez-Perez J., G. Marquez, J. L. Barbero, J. Gutierrez.1994. Increasing the efficiency of protein export in Escherichia con". Bio/Technology 12: 178-180.
Remaut E., H. Tsao, W. Fiers.1983. Improved plas-mid vectors with thermoinducible expression and temperature-regulated runaway regulation. Gene 22: 103-113.
Rogers S., R. Wells, M. Rechsteiner.1986. Amino acid sequences common to rapidly degraded proteins: the PEST hypothesis. Science 234: 364-368.
Sander F. C., R. A. Fachini, D. £. Hughes, J. L. Galazzo, J. E. Bailey.1994. Expression of Vitreoscilla hemoglobin in Corynebacterium glu-tamicum increases final concentration and yield of L-Jysine, p. 607-610, /« L. Alberghina, L. Frontali. P. Sensi ied.). Proceedings of the 6th European Congress on Biotechnology. Eisevier Science B.V., Amsterdam, The Netherlands.
Sassenfeld H. M.,1990. Engineering proteins for purification. Trends Biotechnol. 8: 88—93.
Simmons L. C., D. G. Yansura.1996. Translational level is a critical factor for the secretion of heterol-ogous proteins in Escherichia coli. Nat. Biotechnol. 14:629-634.
Sung W. L., F. L. Yao, D.M. Zahab, S. A. Narang.1986. Short synthetic oligodeoxyribonucleotide leader sequences enhance accumulation of human proinsulin synthesized in Escherichia coli. Proc. Nail. AcaO. Sei. USA 83: 561-565.
Talmadge K., W. Gilbert.1982. Cellular location affects protein stability in Escherichia coli. Proc. Nail. AcaO. Sei. USA 79: 1830-1833.
Taylor W. M., P. J. Hagerman.1987. A general method for cloning DNA fragments in multiple copies. Gene 53: 139-144.
Tobias J. W., T. E. Schrader, G. Rocap,
A. Varshavsky.1991. The N-end rule in bacteria. Science 254: 1374-1377.
Tsuchiya M., Y. Morinaga.1988. Genetic control systems of Escherichia coli can confer inducible expression of cloned genes in coryneform bacteria. Bio/Technology 6: 428-430.
Weinstock G. M., C. A. Rhys, M. L. Berman,
B. Hampar, D. Jackson, T. J. Silhavy, J. Weisemann, M. Zweig.1983. Open reading frame expression vectors: a general method for antigen production in Escherichia coli using pro-
tein fusion to ß-galactosidase. Proc. Natl, Acad. Sei. USA 80: 4432-4436.
Wilcox G., G. M. Studnicka.1988. Expression of foreign proteins in microorganisms. Biotechnol. Appl. Biochem. 10:500-509.
Wilkinson D. L., R. G. Harrison,1991. Predicting the solubility of recombinant proteins in Escherichia coli. Bio/Technology 9: 443—448.
Williams J. G. K., A. A. S/alay. 1983. Stable integration of foreign DNA into the chromosome of the cyanobacterium Synechococcus R2. Gene 24: 37-51.
Wong R.S. Y., R. A. Wirtz, R, E. W. Hancock.1995. Pseudomonas aeruginosa outer membrane protein OprF as an expression vector for foreign epitopes: the effects of positioning and length on the anti-genicity of the epitope. Gene 158:55—60.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какими способами можно влиять на экспрессию генов, клонированных в прокарио-тических организмах?
2. Что такое ген lacIq и как его используют?
3. Почему плазмидный вектор с максимально сильным промотором не всегда является наилучшим экспрессирующим вектором?
4. Что такое tac-промотор и как осуществляется его регуляция?
5. Промотор pL фага λ, способного инфицировать только E. coli, тем не менее иногда используют как составную часть экспрессиру-ющего вектора с широким кругом хозяев. Как «приспособить» рL-промотор для инициации транскрипции в других организмах?
6. Иногда стратегия синтеза белка-мишени включает получение этого белка в составе химерного продукта. В чем преимущество такого подхода? Как создают химерный белок?
7. Что такое тельца включения и как избежать их образования?
8. В чем преимущество локализации чужеродных белков на поверхности клеток? Какие стратегии используются для того, чтобы сделать белки секретируемыми?
9. Как встроить в одну плазмиду несколько копий гена?
134 ГЛАВА 6
10. Как решить проблему обеспечения кислородом клеток Е. соli, синтезирующих в большом количестве чужеродный белок?
11. Последовательность-мишень может быть встроена в хромосомную ДНК двумя способами: 1) сама по себе; 2) в составе плазмиды, которая несет эту последовательность. Как происходит каждое из этих событий? Какие
преимущества или недостатки имеет интеграция плазмидного вектора в хозяйскую ДНК?
12. Что такое метаболические перегрузки и какова их причина?
13. Предложите несколько способов снижения метаболической перегрузки E. coli, синтезирующих в большом количестве рекомбинантный белок.
ГЛАВА 7
Получение рекомбинантных белков с помощью эукариотических систем
Для получения гетерологичных рекомбинантных белков с клонированной уукариотической комплементарной ДН К (кДНК) обычно используются прокариотические системы экспрессии. Однако и некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются нестабильными или биологически неактивными. Кроме того, как бы тщательно ни проводилась очистка, конечный продукт может быть загрязнен токсичными веществами или веществами, вызывающими повышение температуры у человека и животных (пирогенами). Чтобы решить эти проблемы, для получения рекомбинантных белков, предназначенных для использования в медицине, были разработаны эукариотические системы экспрессии. Такие белки должны быть идентичны природным по своим биохимическим, физическим и функциональным свойствам. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций,
Белки в клетках эукариот претерпевают следующие посттрансляционные изменения:
• Образование дисульфидных связей. Эту реакцию катализирует фермент дисульфидизомераза. Неправильно уложенный белок оказывается нестабильным и неактивным.
• Протеолитическое расщепление предшественника, удаление определенного участка полипептидной цепи с образованием функционально активного белка.
• Гликозилирование: основная модификация, благодаря которой белки приобретают ста-
бильность, а в некоторых случаях — особые свойства. Наиболее распространенная реакция гликолизировгшия — это присоединение специфического сахарного остатка либо к серину или треонину (О-гликозилирование), либо к аспарагину (N-гликолизирование).
* Модификации аминокислот в составе белка: фосфорилирование, ацетилирование, ацилирование, гамма-карбоксилирование, сульфатирование, миристилирование и пальмитоилирование.
Из всех этих модификаций прокариотические хозяйские клетки наименее всего способны осуществлять правильное гликозилирование и модификацию специфических аминокислот в гетерологичном белке. Однако ни одна эукариотическая система не может осуществить одновременно все посттрансляционные изменения в каждом потенциальном гетерологичном белке. Таким образом, для получения белка с полным набором специфических модификаций необходимо провести тестирование различных эукариотических систем экспрессии и найти такую, которая воспроизводила бы биологически аутентичный продукт.
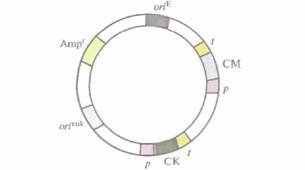
Эукариотические экспрессируюшие векторы имеют такую же структуру, что и их прокариотические аналоги (рис. 7.1), и должны содержать:
* эукариотический селективный маркер
* эукариотический промотор
* соответствующие эукариотические сайты терминации транскрипции и трансляции
* сигнал полиаденилирования мРНК.
136 ГЛАВА 7
|
| Рис. 7.1. Обобщенная структура эукариотического экспрессирующего вектора. Его основные элементы: эукариотический транскриптон с промотором (p), сайтом клонирования (СК) и сигналами терминации и полиаденилирования (t); эукариотический селективный маркер (СМ); сайт инициации репликации, функционирующий в клетках эукариот (orieuk); сайт инициации репликации, функционирующий в E. coli (oriЕ); селективный маркер E. coli (Аmрг). |
Если вектор представляет собой плазмиду, реплицирующуюся независимо от хромосомы, то он должен содержать сайт инициации репликации, функционирующий в хозяйской клетке. Если же вектор предназначен для встраивания в хозяйскую хромосомную ДНК, то для обеспечения рекомбинации он должен нести последовательность, комплементарную определенному участку хромосомной ДНК хозяина (хромосомный сайт интеграции). Поскольку технически многие операции с реком-бинантными ДНК сложнее проводить в клетках эукариот, чем прокариот, большинство эукариотических векторов сконструированы как челночные. Другими словами, эти векторы несут два типа сайтов инициации трансляции и два типа селективных маркерных генов, одни из которых функционируют в Escherichia coli, a другие — в эукариотических хозяйских клетках. Такие векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих.
Введение ДНК в бактериальные и дрожжевые клетки называется трансформацией. В микробиологии этот термин используется для описания наследственных изменений в результате внедрения (приобретения) экзогенной (чужеродной) ДНК, А применительно к животным клеткам трансформация обозначает изменение характера их роста в культуре, обусловленное превращением нормальных клеток в раковые. Чтобы избежать путаницы в терминологии, для обозначения наследственных изменений в животных клетках после введения в них экзогенной ДНК был выбран термин трансфекция.
Для трансформации дрожжей обычно используют три способа. В первом случае экзогенную ДНК добавляют к клеткам дрожжей, клеточные стенки которых удалены химически или энзиматически (протопласты) ( 1 ). В других случаях клетки перед добавлением чужеродной ДНК обрабатывают ацетатом лития (2) или подвергают электропорации (3). Трансфекцию культур животных клеток осуществляют инкубацией клеток с ДНК, осажденной фосфатом кальция или ДЕАЕ-декстраном (1), либо электропорацией в присутствии очищенной трансфи-цирующей ДНК (2). Как уже упоминалось в гл. 4, электропорация заключается в воздействии на клетки коротких мощных импульсов электрического тока, вследствие чего в наружной мембране или клеточной стенке образуются временные поры, через которые в клетку может проникнуть ДНК. В некоторых эукариотических системах для доставки ДНК в реципиент-ные клетки используют вирусы.
Системы экспрессии Saccharomyces cerevisiae
Для экспрессии клонированных эукариотических генов интенсивно используют обычные дрожжи Saccharomyces cerevisiae. Тому есть несколько причин. Во-первых, это одноклеточный организм, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных биорсак горах. Во-вторых, выделены и охарактеризованы несколько сильных промоторов этих дрожжей, а для систем эндогенных дрожжевых экспрессирующих векторов могут использоваться природные, так называемые 2 мкм-плазмиды. В-третьих, в клетках S. cerevisiae осуществляется большое число посттрансляционных модификаций. В-четвертых, лишь очень немногие из собственных дрожжевых белков секретируются в среду; таким образом, если гетерологичный белок секретируется
Получениерекомбинантных белков с помощью эукаристических систем 137
клеткой, то его очистка не составит большого труда. В-пятых, поскольку дрожжи уже многие годы используют в хлебопечении и пивоварении, Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) включил S. cerevisiae в список «организмов, признаных безопасными» (GRAS, generally recognized as safe). Таким образом, использование этих организмов для получения белков, применяемых в медицине, не требует дополнительных экспериментов, необходимых при работе с неразрешенными к применению микроорганизмами. Некоторые белки, синтезированные в S. cerevisiae, уже применяются в качестве вакцин и фармацевтических препаратов, а также для диагностики (рис. 7.2).

|
| Рис. 7.2. Рекомбинантные белки, синтезируемые в системах экспрессии S. cerevisiae. HIV-I — вирус иммунодефицита человека 1 типа. |
Векторы для S. cerevisiae
Существует три типа экспрессирующих векторов для S. cerevisiae. 1) эписомные, или плазмидные векторы; 2) интегрирующие векторы; 3) искусственные дрожжевые хромосомы (YAC). Плазмидные векторы уже широко использовались для получения как секретируемых, так и несекретируемых гетерологичных белков. Однако системы экспрессии, основанные на использовании плазмид, зачастую оказываются нестабильными при выращивании клеток в больших объемах (> 10 л). Стратегия с использованием векторов второго типа пока не получила широкого распространения, несмотря на то что в результате интеграции экспрессирующего вектора или транскриптона в хромосомную ДНК получается стабильный рекомбинантный организм. Причиной этого служит то, что число копий клонированного гена ограничивается одной на хромосому, иными словами, конечный выход белка невысок. Можно было бы использовать тандемные последовательности генов, но они часто оказываются нестабильными. Поэтому исследователи остановились на плазмидных векторах с одним клонированным геном, но попытались изменить условия роста, с тем чтобы повысить стабильность плазмид.
Искусственные дрожжевые хромосомы (YAC) предназначены для клонирования больших фрагментов ДНК (100 т. п. н.), которые затем поддерживаются в дрожжевой клетке как отдельные хромосомы. YAC-система чрезвычайно стабильна. С ее помощью проводили физическое картирование геномной ДНК человека и анализ больших транс-криптонов, создавали геномные библиотеки, содержащие ДНК индивидуальных хромосом человека. YАС-вектор напоминает хромосому, поскольку он содержит последовательность, функционирующую как сайт инициации репликации ДНК (автономно реплицирующуюся последовательность), сегмент центромерной области дрожжевой хромосомы и последовательности, образующиеся на обоих концах при линеаризации ДНК и действующие как теломеры, обеспечивающие стабильность хромосомы (рис. 7.3). При встраивании чужеродной ДНК в YAC может происходить нарушение рамки считывания маркерного дрожжевого гена. В результате продукт этого гена не образуется, и при выращивании клеток на специальной среде можно наблюдать цветную реакцию. Кроме того, некоторые YAC-векторы несут селективный маркер, независимый от сайта клонирования. Несмотря на все преимущества, YAC пока не использовались для промышленного синтеза гетерологичных белков.
Прямая экспрессия в S. cerevisiae
Термин «прямая экспрессия» применяется для описания векторных систем, при использовании которых синтезированные белки аккумули-
138 ГЛАВА 7
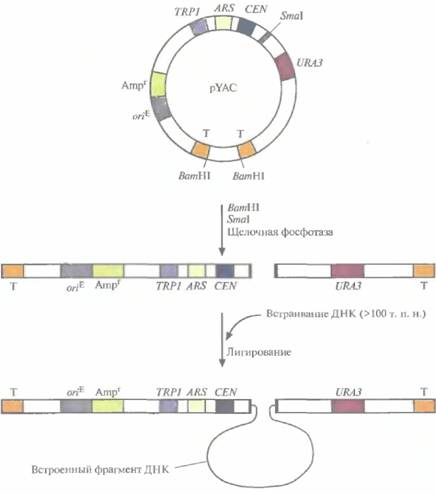
| Рнс. 7.3. YAC-система клонирования. YAC-плазмида (pYAC) содержит селективный маркерный ген E. coli (Ampr), сайт инициации репликации, функционирующий в E. coli (oriE); сегмент дрожжевой ДНК, включающий участки URA3, CEN, TRP1 и ARS (CEN - последовательность, выполняюшая центромерную функцию, ARS дрожжевая автономно реплицирующаяся последовательность, эквивалентная дрожжевому сайту инициации репликации, VRA3 — один из генов биосинтеза урацила, TRP1 - один из генов биосинтеза триптофана). Т — это теломерные области дрожжевой хромосомы, Sinai — сайт, по которому осуществляется клонирование. pYAC сначала обрабатывают SmaI, ВатHIи щелочной фосфатазой, а затем сшивают с фрагментом ДНК длиной 100т. п. н. Конечная генетическая конструкция содержит клонированную ДНК и может стабильно поддерживаться в дрожжевых клетках Ura-Trp- |
руются в цитоплазме хозяйской клетки. Несколькими группами исследователей были разработаны различные экспрессирующие дрожжевые векторы, но все они имеют сходные основные черты. Мы рассмотрим процесс экспрессии чужеродного гена в S. cerevisiae на примере синтеза фермента супероксиддисмутазы человека.
Супероксид-анион — это побочный продукт утилизации кислорода аэробными организмами. У человека он участвует в стимуляции иммунного ответа фагоцитов и направлении лейкоцитов к месту инфекции. Однако избыток данного соединения и его производных может вызывать повреждение клеток. В минимизации потенциального цитотоксического воздействия таких веществ и принимает участие цитоплазматический фермент Cu/Zn-супероксиддисмутаза (Cu/Zn-SOD); он катализирует связывание супероксид-аниона и иона водорода с образованием пероксида водорода, который в свою очередь служит субстратом для каталазы или пероксидазы. Супероксид-анион образуется также при повторной перфузии органа, кровоснабжение которого было прекращено перед хирургическим вмешательством. Чтобы избежать повреждения клеток супероксид-анионом, исследователи предложили перед повторной перфузией вводить в орган Cu/Zn-SOD. Cu/7n-SOD может использоваться также для лечения таких воспалительных заболеваний, как остеоартрит, ревматоидный артрит, склеродермия и болезнь Бехтерева. При этом в
Получение рекомбинантныхбелков с помощью эукариотическихсистем 139
обоих случаях лучше использовать белок, аутентичный Cu/Zn-SOD человека, для того чтобы избежать любых нежелательных иммунных реакций, которые могут возникнуть при введении фермента от других видов.
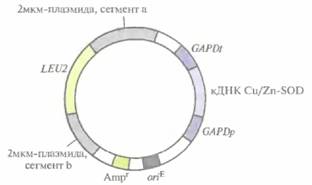
Первоначально кДНК Cu/Zn-SOD человека была клонирована в системе экспрессии Е. coll. Но в этом случае от молекулы Cu/Zn-SOD только отщеплялся инициаторный N-концевой метионин — так, как это происходит со всеми белками, синтезируемыми в Е. coït, a следующая аминокислота (аланин) не ацетилировалась, как в клетках человека. Поэтому для получения аутентичного фермента кДНК Cu/Zn-SOD человека была встроена в дрожжевой эписомный вектор. Дрожжевые клетки не способны эффективно вырезать интроны, поэтому для кодирования специфичных генных продуктов необходимо использовать соответствующие кДНК или химически синтезированные последовательности. Дрожжевой вектор с кДНК Cu/Zn-SOD человека (рис. 7.4) содержал: 1) дрожжевой ген биосинтеза лейцина (LEU2); 2) сегмент 2мкм-плазмиды с сигналом инициации репликации ДНК дрожжей, что обеспечивало репликацию плазмиды в дрожжевых клетках; 3) селективный маркер — Е. соli-ген устойчивости к ампициллину (Ampr) и сайт инициации репликации, активный в Е. œli, что позволяет осуществлять стандартные генноинженерные манипуляции, необходимые для создания плазмиды, в клетках Е. coli; 4) кДНК Cu/Zn-SOD человека, встроенную между промотором дрожжевого гена глицеральдегидфосфатдегидрогеназы (GAPDp) и последовательностью, содержащей сигналы терминации транскрипции и полиаденилирования мРНК того же гена (GAPDt).
Этим вектором трансформировали штамм дрожжей, не способный к синтезу лейцина (LEU2~), и высевали их на среду без лейцина. В этих условиях могут расти только клетки с функционирующим LEU2-геном, находящимся в векторе. GAPD-промоторне регулируется, транскрипция с него происходит непрерывно. Поэтому кДНК Cu/Zn-SOD человека транскрибируется в течение всего периода роста (конститутивно). В этом эксперименте в дрожжевых клетках накапливались большие количества Cu/Zn-SOD, в котором, подобно нативному
|
| Рис. 7.4. Экспрессирующий вектор S. cerevisiae. Между промотором {GAPDp} и сигналом терминации-полиаденилирования (GAPDt) гена глицеральдегидфосфатдегидрогеназы S. cerevisiae встроена кДНК Cu/Zn-SOD человека. Ген LEU2, встроенный в середину дрожжевой 2мкм-плазмиды, кодирует один из ферментов биосинтеза лейцина. Ген устойчивости к ампициллину (Ampr) и сайт инициации репликации Е. coli (oriE) переклонированы из плазмиды pBR322. |
белку из клеток человека, аминогруппа n-концевого остатка аланина была ацетилирована.
Секреция гетерологичных белков, синтезируемых S. cerevisiae
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N-или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователи белок, нужно поместить так называемый пре-про-α-фактор - лидерную (сигнальную) последовательность гена а1фактора спаривания дрожжей. Синтезируемый рекомбинантный белок сможет в этом случае эффективно секретироваться дрожжами.
Во время транспорта белка в нем образуются дисульфидные связи, происходят протеолитическое расщепление и другие посттрансляционные модификации, так что в некоторых случаях в среду попадает уже активный белок. Лидерный пептид обеспечивает проникновение белка через цитоплазматическую мембрану и секрецию, при этом сам он отщепляется дрожжевой эндопротеиназой, узнающей дипептид Lys-Arg. Поэ-
140 ГЛАВА 7
тому кодоны Lys и Arg должны располагаться непосредственно перед кДНК, так чтобы после отщепления сигнального пептида синтезированный белок содержал на N-конце нужный аминокислотный остаток.
Используя эписомный экспрессирующии вектор с сигнальной последовательностью α-фактора, удалось получить правильным образом модифицированный, биологически активный белок гирудин: он синтезировался и секретировался штаммом S. cerevisiae. Ген гирудина был выделен из клеток беспозвоночного — пиявки Hirudo medicinalis. Этот белок является мощным антикоагулянтом и не вызывает нежелательных иммунологических реакций у человека. Его можно получать в активной форме в больших количествах, что упростило исследование его способности разрушать сгустки венозной крови и устранять другие проявления тромбоза. К сожалению, клинические исследования 12 142 больных, у 4131 из которых имелись сердечнососудистые заболевания, выявили лишь незначительные преимущества рекомбинантного гирудина перед гепарином. Эти преимущества не могут компенсировать высокую стоимость рекомбинантного гирудина, так что его широкое использование в клинике представляется маловероятным.
Чтобы повысить эффективность секреции рекомбинантных белков штаммами S. cerevisiae, были предприняты дальнейшие исследования, Так, попытались выяснить, способствует ли повышению выхода рекомбинантного белка суперэкспрессия такого природного фермента системы секреции, как дисульфидизомераза, которая обеспечивает правильную укладку белковой молекулы в процессе секреции. Для этого в хромосому 5. cerevisiae встроили ген дрожжевой дисульфидизомеразы, находящийся под контролем конститутивного промотора глицеральдегидфосфатдегидрогеназы и сигнала терминации транскрипции. Уровень синтеза дисульфидизомеразы модифицированным штаммом был в 16 раз выше по сравнению со штаммом дикого типа. Далее в штамм — суперпродуцент дисульфидизомеразы ввели внехромосомный экспрессирующий вектор, несущий ген фактора роста тромбоцитов В человека. Количество секретируемого этим штаммом тромбоцитарного фактора роста В человека превысило в 10 раз количество фактора, секретируемого штаммом с нормальным уровнем синтеза дисульфидизомеразы. Суперпродукция дисульфидизомеразы повышает секрецию белков только с дисульфидными связями. Изменение других белков дрожжевой системы секреции может повысить количество секретируемых рекомбинантных белков с другими требованиями к укладке белковой молекулы.
Другие дрожжевые системы экспрессии
С помощью систем экспрессии S. cerevisiae удалось получить много разных рекомбинантных белков, К сожалению, в большинстве случаев уровень их экспрессии был довольно низким, Кроме того, обнаружились и другие проблемы.
• При увеличении масштабов системы часто происходит потеря плазмид, даже если используются индуцируемые промоторы.
• Гетерологичный белок зачастую оказывается гипергликозилированным и содержит более 100 остатков маннозы в каждой боковой олигосахаридной цепи, в то время как в нативных белках их содержится только от 8 до 13 на цепь. Наличие лишних маннозных остатков может изменять биологическую активность продукта или его иммуногенность.
• Во многих экспериментах белки, которые должны были секретироваться, на самом деле концентрировались в периплазматическом пространстве, что еще более осложняло их очистку.
Все это заставило ученых исследовать возможность получения гетерологичных белков с помощью других видов дрожжей и с использованием эукариотических систем, В частности, изучались соответствующие векторы — системы экспрессии, содержащие видоспецифичные регуляторные последовательности транскрипции и трансляции, возможность трансформации этих видов и получения высокого выхода белков и возможность крупномасштабного культивирования организма-хозяина, В качестве альтернативы S. cerevisiae можно использовать Kluyveromyces lactis, дрожжи, которые применяют для промышленного производства лактозы
Получение рекомбиантныхбелков с помощью эукариотических систем 141
(ß-галактозидазы); Schizosaccharomyces pombe, дрожжи, размножающиеся делением, а не почкованием; Yarrowia lipotytica, которые используют алканы в качестве субстрата; Pichia postons и Hansenula polymorphe, которые могут использовать метанол как единственный источник углерода и энергии.
Синтез поверхностного антигена вируса гепатита В
Метилотрофные дрожжи P. pastoris можно без труда и больших затрат выращивать в промышленных биореакторах. Их использование в качестве организма-хозяина позволило бы увеличить выход активных продуктов — гетерологичных белков. Такой вывод можно сделать, рассмотрев в качестве примера получение поверхностного антигена вируса гепатита В (HBsAg) с помощью специально разработанной системы с использованием интегрирующего вектора. Сначала ген HBsAg встроили между промотором гена алкогольоксидазы 1 (АОХ1р) и сигналом терминации-полиаденилирования (AOX1t) того же гена (рис. 7.5). Регуляция активности гена АОХ1 Р. posions осуществляется с помощью метанола. В
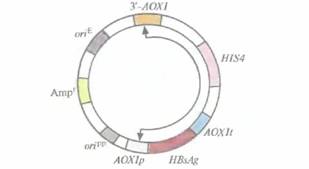
|
| Рис. 7.5. Интегрирующий экспрессирующий вектор для P. pastoris. Между промотором (AOXlp) и сигналом терминации-полиаденилирования (AOXÎi) гена алкогольоксидазы 1 P. pastoris встроен ген HBsAg. HIS4— ген, кодирующий один из ферментов биосинтеза гистидина, гистидинолдегидрогеназу. Кроме того, вектор содержит сайт инициации репликации Р. pastoris (оripp), ген устойчивости к ампициллину (Аmpr) и сайт инициации репликации, активный в Е. coli (оriЕ). 3'-AOX1 — это фрагмент 3'-концевой последовательности гена алкогольоксидазы 1 P. pastoris. Стрелками указан сегмент, который интегрируется в геном P. pastoris. |
его присутствии на долю алкогольоксидазы может приходиться до 30% всех белков клетки, а в отсутствие метанола алкогольоксидаза не синтезируется вообще.
Вектор (рис. 7.5), специально сконструированный для этих исследований, содержал следующие элементы: 1) блок AOX1p-HBsAg-AOX1t; 2) сайт инициации репликации, функционирующий в P. pastoris; 3) фрагмент ДНК, содержащий сайт инициации репликации плазмиды pBR322 и селективный маркер E. coli; 4) фрагмент 3'-АОХ1, способствующий интеграции клонированной ДНК в определенный сайт хромосомы; 5) активный ген гистидинолдегидрогеназы (HIS4), кодирующий фермент, который участвует в синтезе аминокислоты гистидина. Наличие в этой конструкции последовательностей pBR322 позволяет использовать для работы с ней E. coli, что облегчает клонирование и при необходимости позволяет получать большие количества векторной ДНК.
Чтобы предотвратить утрату плазмиды. была предусмотрена интеграция участка AOX1p-HBsAg-AOX1t в геном P. pastoris. Для этого штамм P. pastoris HIS4~ с дефектным геном гистидинолдегидрогеназы трансформировали фрагментом вектора, содержащим элементы AOX1p-HBsAg-AOX1t, HIS4 и 3'-АОХ1 (рис. 7.5). В результате двойного кроссинговера между AOX1p и 3'-АОХ1 введенной ДНК, с одной стороны, и комплементарными последовательностями хромосомной ДНК, с другой, произошла интеграция последовательностей AOX1p-HBsAg-AOX1t и Н1S4 вгеном, сопровождающаяся утратой хромосомного гена АОХ1 (рис. 7.6). Клетки, в геном которых включился ген HIS4, растут на среде без гистидина; этот признак может использоваться для их отбора. Вторым критерием отбора служит замедление роста клеток в присутствии метанола, поскольку после потери гена АОХ1 после двойного кроссинговера активным остается только один, менее эффективный ген АОХ2.
Клон с интегрировавшим фрагментом AOX1p-HBsAg-AOX1t при росте в присутствии метанола, который активирует АOX1-промотор, синтезировал в больших количествах аутентичный белок HBsAg, накапливающийся в цитоплазме. Белковый продукт образовывал такой
142 ГЛАВА 7
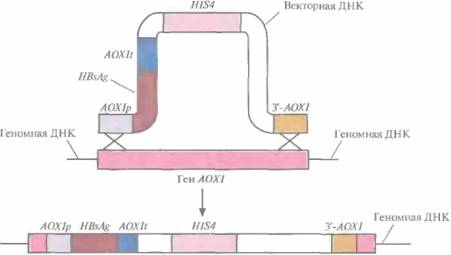
|
| Рис. 7.6. Интеграция части экспрессирующего вектора в ген алкогольоксидазы 1 P. pastoris. В результате двойного кроссинговера между геном АОХ1 и участками AOX1p и 3'-AOX1 (верхняя часть рисунка) происходит интеграция вектора в геномную ДНК и утрата большей части гена алкогольоксидазы 1 (AОX1) хозяйской хромосомой (нижняя часть рисунка). Продукт гена HIS4 дает возможность клеткам расти на среде без гистидина. В присутствии метанола AOX1p активирует транскрипцию гена HBsAg, a AOX1t обеспечивает терминацию транскрипции и полиаденилирование. |
же мультисубъединичный комплекс, как и соответствующий белок в клетках человека, инфицированных вирусом гепатита В, и связывался с антителами к этому вирусу. При выращивании данного клона в 240-литровом ферментере периодического действия количества синтезируемого белка хватило бы примерно на 107 вакцинаций. При этом генетическая конструкция оставалась неизменной в течение 200 часов культивирования в присутствии метанола,
Синтез бычьего лизоцима С2
Способность P. pastoris секретировать гетерологичный белок исследовали в системе с использованием кДНК бычьего лизоцима С2, кодирующей полноразмерный белок и его собственный лидерный пептид. Бычий лизоцим — это желудочный фермент, разрушающий клеточные стенки бактерий; он устойчив к протеазам и сохраняет активность в узком диапазоне pH, что позволяет использовать его в качестве добавки к кормам жвачных животных для улучшения пищеварения.
Вектор, созданный для этого исследования, был идентичен вектору AOX1p-HBsAg-AOX1t, описанному выше, за исключением того, что вместо кодирующей последовательности HBsAg в него была встроена кДНК лизоцима. Вся плазмида была интегрирована в дефектную копию гена HIS4 в хромосоме P. pastoris. В результате интеграции ген бычьего лизоцима оказывался фланкирован одним активным (HIS4) и одним дефектным (HIS4–) генами гистидинол-дегидрогеназы (рис. 7.7). Предшественник бычьего лизоцима процессировался в P. pastoris и секретировался в среду, при этом удельная активность секретируемого белка была такой же, как у нативного фермента. При ферментации 10 л культуры в течение 200 ч в непрерывном режиме при высокой плотности клеток синтезировалось примерно 20 г лизоцима.
Аутентичные гетерологичные белки были получены и с помощью других дрожжевых систем. Например, кДНК α- и ß-цепей гемоглобина А человека были встроены между промотором (МОХр) и сигналом терминации транскрипции (MOXt) гена метанолоксидазы Hansenula polymorpha и помещены друг за другом в экспрессирующий вектор. Через 40 генераций был взят изолят со случайно интегриро-
Получение рекомбинантных белков с помощью эукариотических систем 143
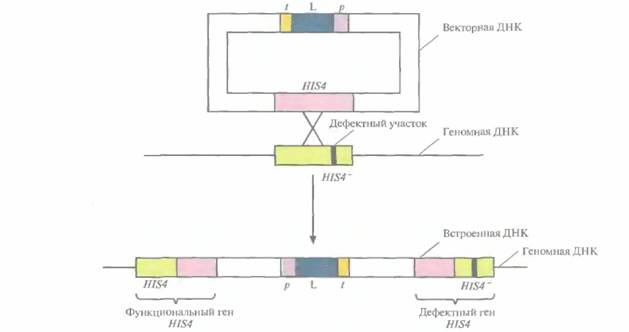
|
| Рис. 7.7. Интеграция экспрессирующего плазмидного вектора в дефектный хромосомный ген HIS4~ P. pasioris, В результате кроссинговера между плазмидным геном Н1S4 игеном HIS4~ клетки-хозяина происходит интеграция в геном всей плазмиды, которая оказывается фланкированной функциональным и дефектным генами HIS4. p, L и t — промотор AOX1, кДНК бычьего лизоцима С2 и сигнал терминации транскрипции-полиаденилирования соответственно. Черная полоска — дефектный участок в HIS4~-гене. |
вавшим участком исходного вектора и показано, что в нем присутствует функциональный гемоглобин А с правильной тетрамерной структурой: две α - и две ß-цепи (α2β2). Кроме того, с использованием экспрессирующего вектора для S. pombe, несущего селективный маркерный ген и клонированный ген человека, оба под контролем промоторов млекопитающих, были получены большие количества рекомбинантных белков, кодируемых разными генами человека.
Дрожжевые системы экспрессии стали играть важную роль в получении гетерологичных белков для научных, промышленных и медицинских целей. Однако, как показали исследования, ни одна из них не может гарантировать получение аутентичного белка любого гена. По этой и ряду других причин были разработаны системы экспрессии генов с использованием клеток насекомых и млекопитающих.
Системы экспрессии с использованием культур клеток насекомых
Бакуловирусы инфицируют только беспозвоночных, в том числе многих насекомых. В ходе инфекционного процесса образуются две их формы. Одна представлена отдельными вирио-нами, которые высвобождаются из инфицированной клетки хозяина, как правило клетки средней кишки, и способны инфицировать другие клетки этого органа. Вторая состоит из множества вирионов, заключенных в белковый матрикс. Белок этого матрикса называется полиэдрином, а сама структура — полиэдроном. Синтез полиэдрина начинается через 36—48 ч после инфекции и продолжается 4—5 сут, пока зараженные клетки не лизируют и хозяйский организм не погибнет. После этого множество таких частиц высвобождается и попадает в среду, где от инактивации их защищает белковый
144 ГЛАВА 7
матрикс. Если восприимчивый хозяйский организм проглатывает такую частицу, то полиэдрин солюбилизируется и высвобождаются вирионы, способные инициировать новый инфекционный цикл.
Промотор гена полиэдрина чрезвычайно сильный, а цикл развития вируса не зависит от наличия самого гена. Следовательно, замена последнего геном чужеродного белка с последующей инокуляцией полученным рекомбинантным бакуловирусом культуры клеток насекомого может привести к синтезу большого количества гетерологичного белка, который благодаря сходству систем внесения посттрансляционных модификаций у насекомых и млекопитающих будет близок (а возможно, и идентичен) к нативной форме того белка, который интересует исследователя. Исходя из этого на основе бакуловирусов были разработаны векторы для экспрессии генов, кодирующих белки млекопитающих и вирусов животных.
Наиболее широко используется вирус множественного ядерного полиэдроза Autographa californica (AcMNPV). Этот бакуловирус инфицирует более 30 других видов насекомых, а также хорошо растет в культуре многих клеточных линий. Линии клеток, обычно использующиеся для работы с рекомбинантным AcMNPV, получают из гусениц Spodoptera frugiperda. Промотор полиэдрина в этих клетках чрезвычайно активен, и при их заражении бакуловирусом дикого типа синтезируются большие количества белка.
Система экспрессирующих векторов на основе бакуловирусов
Первый шаг в конструировании рекомбинантного
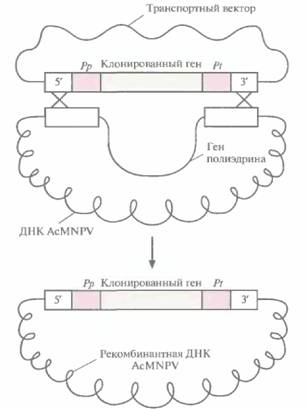
бакуловируса AcMNPV состоит в создании транспортного вектора. Транспортный вектор - это производная плазмиды E. coli, содержащая фрагмент ДНК AcMNPV (рис. 7.8), который включает: 1) промоторную область и расположенную перед ней последовательность ДНК AcMNPV, необходимую для гомологичной рекомбинации с AcMNPV; 2) сайт для клонирования; 3) сайт терминации-полиаденилирования гена полиэдрина и прилегающую к нему последовательность ДНК AcMNPV — вторую область, обеспечивающую гомологичную рекомбинацию с AcMNPV (рис. 7.8). Кодирующая последовательность гена полиэдри-
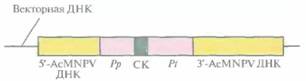
|
| Рис. 7.8. Схематическое представление единицы экспрессии транспортного вектора на основе бакуловирусов (AcMNPV). Ген белка-мишени встраивают в сайт клонирования (СК) между промотором гена полиэдрина (Рр) и сайтом терминации его транскрипции (Pt). Перед промотором и после сайта терминации транскрипции встраивают фрагменты ДНК AcMNPV (5'-АсМNPV ДНК и 3'-AcMNPV ДНК соответственно), обеспечивающие интеграцию единицы экспрессии в ДНК AcMNPV за счет гомологичной рекомбинации в клетках насекомого. |
на из этого фрагмента удалена. Интересующий исследователя ген встраивают между промотором и сигналом терминации гена полиэдрина и вводят конструкцию в Е. соli.
Культуру клеток насекомого, трансфицированную ДНК AcMNPV, трансфицируют затем транспортным вектором, несущим клонированный ген. В некоторых дважды трансфицированных клетках происходит двойной кроссинговер, в результате которого клонированный ген вместе с промотором и сигналом терминации транскрипции гена полиэдрина встраивается в ДНК AcMNPV (рис. 7.9), замещая ген полиэдрина. Вирионы, не содержащие этого гена, образуют зоны клеточного лизиса, из которых можно выделить рекомбинантный бакуловирус.
Визуальная идентификация зон лизиса — утомительная и субъективная процедура. Вместо нее для обнаружения рекомбинантных бакуловирусов можно использовать ДНК-гибридизацию или полимеразную цепную реакцию (ПЦР). Кроме того, если под контроль промотора бакуловируса, активного с ранних и до поздних стадии литического цикла, поместить ген lacZ E. coli., кодирующий ß-галактозидазу, и такую конструкцию включить во фрагмент ДНК, встраивающийся в геном AcMNPV, то в присутствии хромогенного субстрата ß-галактозидазы зоны с рекомбинантными вирусами окрасятся в синий цвет.
Гетерологичный белок, синтезируемый культурой клеток насекомого-хозяина, зараженной
Получение рекомбинантных белков с помощью эукариотических систем 145
|
| Рис. 7.9. Замещение гена полиэдрина AcMNPV единице и экспрессии транспортного вектора в результате двойного кроссинговера в 5'- и 3 '-фрагментах. |
рекомбинантным бакуловирусом, можно выделять через 4—5 сут. С помощью системы экспрессирующих векторов на основе бакуловирусов уже получено более 500 различных
гетерологичных белков, при этом более 95% из них имели правильные посттрансляционные модификации (рис. 7.10).
Получение рекомбинантных бакуловирусов
Исходная методика получения рекомбинантных бакуловирусов в дальнейшем была изменена по ряду причин. Во-первых, применение промотора гена полиэдрина имеет ограничения: белки, синтезирующиеся на поздней стадии литического цикла, часто оказываются модифицированными не до конца. Для решения этой проблемы промотор гена полиэдрина заменили одним из сильных промоторов AcMNPV, активно функционирующих с самого начала и до конца литического цикла. Во-вторых, линеаризация генома AcMNPV перед трансфекцией клеток насекомого увеличивает долю зон лизиса с реком-бинантными вирусами. Расщепление генома AcMNPV в одном сайте уменьшает число зон с нерекомбинантными вирусами, потому что линеаризованные геномы бакуловирусов обладают ограниченной инфицирующей способностью. В результате двойного кроссинговера между линеаризованной ДНК AcMNPV и кольцевым транспортным вектором образуется замкнутая кольцевая молекула, которая обладает инфицирующей способностью. Чтобы обеспечить стабильную линеаризацию в каждом эксперименте, в геном AcMNPV дикого типа в ген полиэдрина встроили уникальный сайт для рестриктазы Bsu361. В результате доля зон лизиса с рекомбинантными бакуловирусами увеличилась с <1% (когда использовались нерасщепленные кольцевые молекулы AcMNPV) до примерно 30%.

|
| Рис. 7.10. Некоторые рекомбинантные белки, синтезированные в системе экспрессирующих векторов на основе бакуловирусов. HIV-1 — вирус иммунодефицита человека 1 типа; HSV - вирус простого герпеса. |
146 ГЛАВА 7

| |
| Синтез ß-глобина кролика в культуре почечных клеток обезьяны, инфицированных рекомбинантным SV40 R, С. Mulligan, В. H. Howard. P, Berg Nature 277: 108-114, 1979 | |
| На первый взгляд разработка любой эукариотической системы экспрессии представляется относительно простой процедурой, состоящей в подборе соответствующих регуляторных последовательностей, встраивании их в вектор в определенном порядке и клонировании гена-мишени таким образом, чтобы обеспечивалась его эффективная экспрессия. На практике же создание первого поколения эукариотических экспрессирующих векторов оказалось весьма кропотливым делом, основанным на методе проб и ошибок. До появления работы Муллигана, Хоуарда и Берга | в векторы млекопитающих на основе SV40 было встроено множество разных генов, однако после введения их в хозяйские клетки зрелые функциональные мРНК не обнаруживались, Муллиган и др. встроили кДНК ß-глобина кролика в один из генов SV40, из которого была удалена почти вся |
Дата добавления: 2015-07-14; просмотров: 2023;
