Структурная организация белков
Существует четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная, четвертичная.
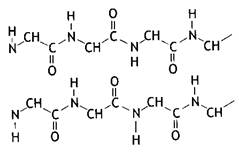
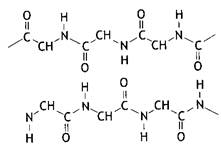
Первичная структура– это каркас белковой молекулы, аминокислотные остатки которой соединены между собой в цепь пептидными связями, которые представляют собой один из типов амидных связей, образованные a-карбокисльными и a-аминогруппами соседних аминокислотных остатков:
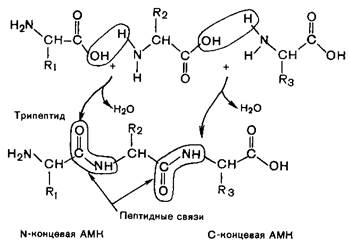
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы.
Если связаны два аминокислотных остатка, то олигомер называют дипептидом, три - трипептидом и т.д. В отличие от небольших олигомеров полипептидами называют вещества, содержащие от 20 и выше аминокислотных остатков. Полипептидные цепи белков могут содержать от 50 до нескольких тысяч аминокислотных остатков.
Для каждого индивидуального белка последовательность аминокислот в полипептидной цепи является уникальной. Она определяется генетически и в свою очередь определяет более высокие уровни организации данного белка.
Вторичная структура белков представляет собой укладку (складывание, упаковку) полипептидной цепи в определенную конформацию (a-спираль, β-структура). При конформации α-спирали, которая характерна для глобулярных белков, происходит закручивание полипептидной цепи по часовой стрелке (правый ход спирали). Стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят пептидные и дисульфидные). Водородные связи в белковой молекуле образуются между пептидными цепями, между двумя гидроксильными группами, между ионизированной СООН-группой и ОН-группой тирозина, между ОН-группой серина и СО-группой пептидной цепи.
Водородные связи, являясь нековалентными, отличаются малой прочностью. Но поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
В структуре a-спирали имеется ряд закономерностей (рис. 1). На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси спирали) равен 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 260, через пять витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется.
Для каждого белка характерна определенная степень спирализации его полипептидной цепи. Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи, a-спиральные участки могут чередоваться с линейными.
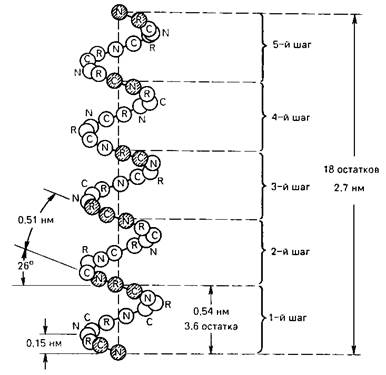
Рис. 1. Структура a-спирали
b-структура (b-складчатый слой) характерна для белков волос, шелка, мышц и других фибриллярных белков. Полипептидная цепь в этой структуре находится в растянутом состоянии, а ее С=О- и N-H-группы связаны водородными связями с такими же группами соседней, параллельно ориентированной полипептидной цепи. Обе цепи могут быть независимыми или представлять фрагмент одной общей для них цепи (рис. 2).
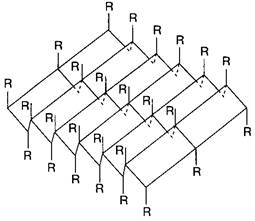
Рис. 2. b-структура полипептидных цепей
b-Структуру называют складчатым слоем потому, что a-углеродные атомы аминокислотных остатков расположены попеременно по обе стороны центральной плоскости слоя. Образующие складчатый слой полипептидные цепи могут быть направлены в одном и том же или противоположном направлении (параллельная и антипараллельная b-структура) (рис. 3).
А б
Рис. 3. Структура b-складчатого слоя
а) участок параллельного b-складчатого слоя,
б) участок антипараллельного b-складчатого слоя
Между вторичной и третичной структурами белковой молекулы существует два уровня (промежуточные) – надвторичные структуры и домены. Надвторичные структуры представляют собой агрегаты полипептидных цепей, обладающие собственной вторичной структурой. Например, в белках открыты bхb-элементы (две параллельные b-цепи, связанные сегментом х), babab-элементы (сегменты a-спирали между тремя параллельными цепями).
Домены (белковые модули) – компактная структурная единица внутри полипептидной цепи, сходная по своим свойствам с самостоятельными глобулярными белками (рис. 4). Домен автономен.

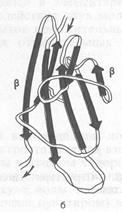

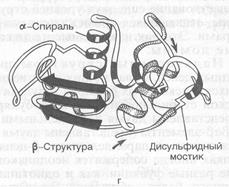
Рис. 4. Доменное строение глобулярных белков
а) b-субъединица гемоглобина, б) константный домен иммуноглобулина,
в) флаводоксин, г) лизоцим куриного яйца
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной цепи в определенном объеме. Процесс укладки синтезированной полипептидной цепи, формирование пространственной структуры называется фолдингом. Стабилизируют третичную структуру различные типы связей (рис. 5), но главную роль играют гидрофобные силы, благодаря которым гидрофобные радикалы аминокислот локализованы в центральной части молекулы, а полярные радикалы ориентированы в сторону воды.
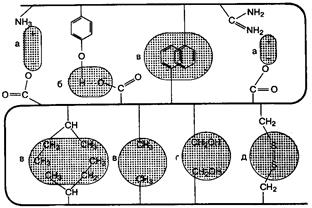
Рис. 5. Типы связей, стабилизирующих третичную структуру белка
а – электростатическое взаимодействие; б – водородная связь; в – гидрофобные взаимодействия неполярных групп; г – диполь-дипольные взаимодействия; д – дисульфидная (ковалентная) связь.
Третичная структура содержит функциональную (интрамолекулярную) информацию о биологических свойствах белков (все биологические свойства белков связаны с сохранностью третичной структуры) (рис. 6).
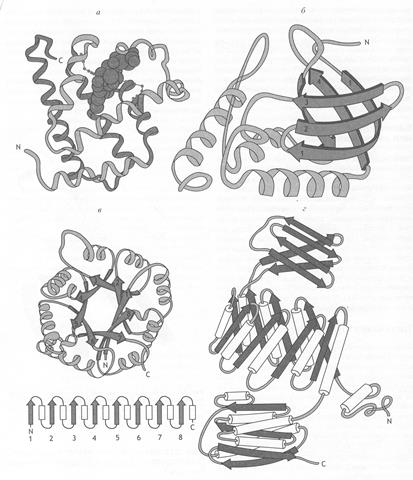
Рис. 6. Строение различных белков
а) миоглобин, в центре которого расположен гем, б) стафиллококковая нуклеаза,
в) триозофосфатизомераза (под ней показано расположение a-спиралей и b-складчатого слоя),
г) пируваткиназа
Существует много белков (олигомерные, субъединичные), молекулы которых представляют собой комплексы, образованные из нескольких белковых молекул. Укладку субъединиц в таком комплексе называют четвертичной структурой белка. Четвертичная структура поддерживается исключительно силами слабых взаимодействий, поэтому она представляет собой лабильное образование, значительно менее прочное, чем третичная и вторичная структуры.
Примером олигомерной молекулы являются, например, гемоглобин (рис. 6), содержащий четыре полипептидные цепи, каждая из которых окружает группу гема; вирус табачной мозаики; фермент лактатдегидрогеназа и т.д.
Дата добавления: 2015-07-06; просмотров: 3498;
