Спектр атома водорода по Бору
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем, состоящих из ядра с зарядом 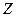 и одного электрона (ионы
и одного электрона (ионы  ,
, 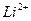 ), а также теоретически вычислить постоянную Ридберга.
), а также теоретически вычислить постоянную Ридберга.
Рассмотрим движение электрона в водородоподобной системе по стационарным круговым орбитам.
Решая совместно уравнение 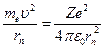 , вытекающие из планетарной модели Резерфорда, и уравнение для момента импульса стационарных орбит
, вытекающие из планетарной модели Резерфорда, и уравнение для момента импульса стационарных орбит  , получим выражение для радиуса
, получим выражение для радиуса 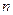 -ой стационарной орбиты. Помножим правую и левую часть первого уравнения на
-ой стационарной орбиты. Помножим правую и левую часть первого уравнения на 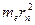 :
:
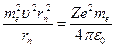 .
.
Возведем обе части второго уравнения  , в квадрат:
, в квадрат:
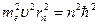 .
.
Из этих уравнений можно выразить значение радиуса:
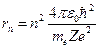 ,
, 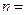 1, 2, 3, …
1, 2, 3, …
Из этого выражения следует, что радиусы орбит растут пропорционально квадрату целых чисел. Для водорода ( 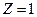 ) радиус первой электронной орбиты (
) радиус первой электронной орбиты ( 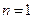 ) равен:
) равен:
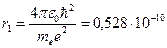 м,
м,
что соответствует размерам атома, рассчитанным из молекулярно-кинетической теории газов.
Теперь подсчитаем полную энергию электронов, находящихся на стационарных орбитах. Полная энергия электрона складывается из его кинетической энергии 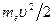 и потенциальной энергии в электростатическом поле ядра
и потенциальной энергии в электростатическом поле ядра 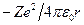 :
:
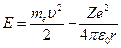 .
.
Учитывая уравнение 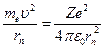 и выражение для радиуса
и выражение для радиуса 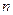 -ой орбиты
-ой орбиты 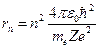 , получим выражение для полной энергии в виде:
, получим выражение для полной энергии в виде: 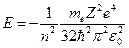 .
.
Учитывая, что 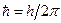 , окончательно получим:
, окончательно получим:
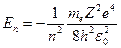 .
.
Энергетические состояния атома образуют последовательность энергетических уровней, меняющихся в зависимости от значения 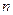 . Число
. Число 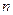 , определяющее энергетические уровни атома, называется главным квантовым числом. Состояние с
, определяющее энергетические уровни атома, называется главным квантовым числом. Состояние с 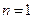 называется основным, состояния с
называется основным, состояния с 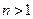 - возбужденными. Придавая
- возбужденными. Придавая 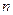 различные целочисленные значения, получим для атома водорода (
различные целочисленные значения, получим для атома водорода ( 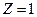 ) возможные уровни энергии.
) возможные уровни энергии.
Энергия атома водорода с увеличением 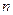 возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются с границе, соответствующей значению
возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются с границе, соответствующей значению 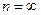 . Минимальная энергия атома водорода равна
. Минимальная энергия атома водорода равна 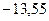 эВ при
эВ при 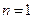 , максимальная энергия равна нулю при
, максимальная энергия равна нулю при 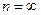 . Значение
. Значение  соответствует ионизации атома (отрыву от него электрона).
соответствует ионизации атома (отрыву от него электрона).
Согласно второму постулату Бора при переходе атома водорода из стационарного состояния 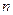 в состояние с меньшей энергией
в состояние с меньшей энергией 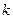 испускается квант с энергией:
испускается квант с энергией:
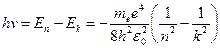 .
.
Откуда частота излучения равна:
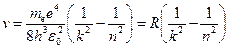 ,
,
где 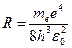 .
.
Величина 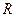 , рассчитанная по этой формуле, совпала с экспериментальным значением постоянной Ридберга в эмпирической формуле для атома водорода.
, рассчитанная по этой формуле, совпала с экспериментальным значением постоянной Ридберга в эмпирической формуле для атома водорода.
Подставляя 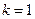 и
и 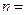 2, 3, 4,… получаем серию Лаймана (переходы с возбужденных уровней
2, 3, 4,… получаем серию Лаймана (переходы с возбужденных уровней 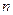 на основной
на основной 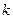 ). При подстановке
). При подстановке 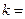 2, 3, 4, 5, 6 и соответствующих им значений
2, 3, 4, 5, 6 и соответствующих им значений 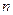 получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри.
получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри.
Спектр поглощения атома водорода является также линейчатым, но содержит только серию Лаймана. Так как свободные атомы водорода находятся в основном состоянии, то при сообщении атомам энергии извне могут наблюдаться лишь переходы из основного состояния в возбужденные.
Таким образом, теория Бора позволила вычислить частоты спектральных линий атома водорода и водородоподобных систем, но не могла объяснить их интенсивности и почему вероятность различных переходов разная. Теория Бора не смогла объяснить спектр атома гелия, содержащего два электрона в поле ядра. Теория Бора содержит внутренние противоречия: она основывается на классической физике, но вводит квантовые постулаты. Теория Бора является переходной от классической физики к квантовой.
Лекция 11
Элементы квантовой механики
Дата добавления: 2015-08-21; просмотров: 1878;
