Равновесие в процессах адсорбции и ионном обмене
Равновесие сорбционных процессов описывается в виде зависимостей поглощательной способности от температуры и концентрации извлекаемого вещества.
Поскольку условия адсорбционного равновесия изучают при постоянной температуре, получаемая функция называется изотермой адсорбции. Конкретная форма этой зависимости определяется свойствами и механизмом взаимодействия адсорбента и адсорбируемого вещества.
В настоящее время в связи с разнообразием адсорбентов и адсорбируемых веществ единая теория адсорбции не разработана, но на основании различных моделей предложены различные виды изотерм. К ним относятся уравнения Эйкена и Поляни, Брунауэра, Эммета, Теллера и др.
Большой вклад в развитие теории и практики процессов адсорбции в нашей стране принадлежит академику М. М. Дубинину.
Для описания физической адсорбции наибольшее применения получила теория Ленгмюра, изотерма адсорбции которой описывается уравнением

где Х – равновесная концентрация поглощенного адсорбентом вещества, кг/кг адсорбента; р – равновесное давление поглощаемого вещества в парогазовой смеси; а, b – константы, определяемые опытным путем.
В ряде случаев вместо уравнения (13.1) используется изотерма Фрейндлиха, имеющая вид
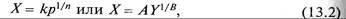
где Y – равновесная концентрация поглощаемого вещества в парогазовой смеси или растворе, кг/кг инертной части; k, n, А, В – константы, определяемые опытным путем.
Количество вещества, поглощенного адсорбентом, часто называют активностью а.
На активность оказывают влияние следующие факторы.
1. Природа поглощаемого вещества. Как правило, активность тем выше, чем больше молекулярный вес поглощаемого газа, а в случае растворов – чем меньше растворимость поглощаемого вещества в жидкости.
2. Температура. С увеличением температуры равновесная активность адсорбента уменьшается.
3. Давление. С увеличением давления равновесная активность адсорбента увеличивается.
4. Примеси в фазе, из которой поглощается вещество, уменьшают равновесную активность.
Рассмотренные факторы оказывают противоположное влияние на процесс десорбции, которому способствуют повышение температуры адсорбента, понижение давления, наличие в фазе над адсорбентом примесей (вытесняющего) вещества.
В промышленных условиях десорбцию часто проводят насыщенным водяным паром, так как при этом выполняются практически все вышеперечисленные условия.
Важными характеристиками адсорбента является его статическая и динамическая активности.
Статическая активность – количество адсорбируемого вещества, которое поглощается к моменту достижения равновесия единицей массы (объема) адсорбента при данной температуре.
Динамическая активность – количество адсорбируемого вещества, поглощенного единицей массы (объема) адсорбента при пропускании через него газа или жидкости до начала проскока.
Момент проскока – это момент обнаружения поглощаемого вещества в выходящем из адсорбера потоке газа или жидкости.
Динамическая активность всегда меньше статической. Поэтому расход адсорбента на установку определяют обычно по динамической активности адсорбента.
Если имеется слой адсорбента высотой Н > Н0, продолжительность его поглотительного действия τ определяется уравнением Н.А. Шилова, полученным им для определения времени защитного действия противогаза,
τ= τ + k*(Н – Н0),
где k – коэффициент поглотительного действия, с/м; Н0 – высота слоя адсорбента, на котором за время τ0 формируется профиль фронта равных концентраций, м. Значения k, Н0 и τ0 определяются экспериментально.
Состояние равновесия при ионном обмене, так же как и при адсорбции, описывается изотермами равновесия, к которым с удовлетворительной сходимостью относятся уравнения Ленгмюра (13.1) и Фрейндлиха (13.2).
На равновесие в процессе ионного обмена влияют природа ионита и поглощаемых ионов, температура и рН раствора.
Так, в случае ионной сорбции двух ионов с разными зарядами ионит преимущественно поглощает ион с наибольшим зарядом.
Активность и избирательность ионитов также уменьшается при повышении температуры. Влияние рН раствора на состояние равновесия различно: с увеличением рН емкость катионитов увеличивается, a анионитов – уменьшается.
Дата добавления: 2015-08-14; просмотров: 1796;
