Одномоментные исследования
Одномоментные (поперечные) исследования одни из наиболее часто проводимых эпидемиологических исследований, особенно в качестве пилотажных. Одномоментные исследования не являются типичными аналитическими исследованиями, поскольку их главная цель – оценка распространенности среди населения какой–либо болезни на данный момент времени.
Так как одномоментным исследованием предусмотрено выявление всех случаев болезни, существующих на данный момент, его также называют – «исследованием на распространенность (пораженность)», а результаты одномоментного исследования нередко выражаются в показателях моментной превалентности.
Оценка распространенности проводится только по результатам активного выявления больных, а не по данным их официальной регистрации. Выявление, чаще всего, проводиться с помощью различных скрининговых тестов (опрос, физикальное обследование, лабораторные тесты). При этом вначале может быть проведено интервьюирование населения (репрезентативных выборок или всего населения), с последующим использованием других скрининговых тестов и, при необходимости, клинического обследования.
При описании полученных данных предусматривается группировка выявленных случаев, в основном по индивидуальным признакам, реже по признаку места.
Результаты таких широкомасштабных, одномоментных исследований представляют интерес не только для науки, в них весьма заинтересованы управленческие организации здравоохранения. Данные одномоментных исследований, в определенной степени, позволяют оценить качество существующей системы выявления и учета больных, и лучше представить медицинские проблемы населения. В литературе широко публикуются результаты поперечных исследований, выполненные в разных регионах (странах). При этом следует учитывать, что величина выявленной распространенности болезни среди населения разных территорий зависит не только от активности факторов риска, но и в значительной степени от методов оценки состояния здоровья.
Таким образом, поперечное исследование, выполняет, прежде всего, описательную цель.
Аналитический вариант одномоментного исследования представляет некое сочетание особенностей организации когортного исследования и исследования случай-контроль.
Так же как когортное исследование:
· одномоментное исследование начинается с определения изучаемой популяции,
· случаи, которые составят основную группу не отбираются по воле исследователя из числа имеющихся, а выявляются в ходе исследования
Отличия:
· в когортном исследовании наблюдение продолжительное, в одномоментном исследовании кратковременное.
· контрольная группа, специально не формируется – ее составляют лица, у которых не выявлены искомые заболевания.
Так же как в исследовании случай контроль:
· факт воздействия предполагаемых факторов риска устанавливается путем сбора анамнеза у лиц основной и контрольной группы и (или) на основании документов, зафиксировавших воздействие факторов риска.
· факт воздействия предполагаемых факторов риска устанавливается после возникновения случаев болезни. Поэтому, связь болезни с фактором риска в одномоментном исследовании оценивается по величине показателя отношение шансов, а об относительном риске можно судить лишь в терминах качества (больше/меньше).
В заключение отметим, наличие двух вариантов проведения поперечных исследований привело к тому, что в разных изданиях их относят либо к описательным, либо аналитическим исследованиям. Более того, в книге «Клиническая эпидемиология» Р. Флетчер с соавторами, Медиа Сфера, Москва, 1998, в словаре терминов отмечается «одномоментное исследование………вариант описательного исследования……», а в тексте книги то же исследование фигурирует как аналитическое и правомерно сравнивается с когортным исследованием и исследованием случай – контроль (табл. 10).
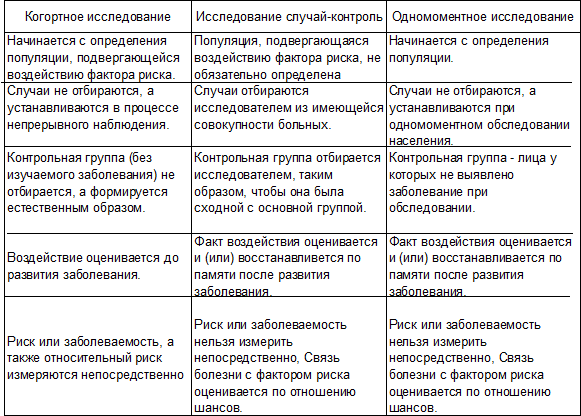
Таблица 10. Основные характеристики когортного исследования, исследования случай-контроль и одномоментного исследования. Источник. Клиническая эпидемиология. Р. Флетчер с соавт., Медиа Сфера, Москва 1998.
Экспериментальные аналитические эпидемиологические исследования.
Принципы проведения (Введение)
Медицина, особенно во второй половине 19 и в 20 веке, добилась значительных успехов в выяснении причин возникновения и распространения болезней, что послужило основой разработки новых способов их диагностики, лечения и профилактики, многие из которых обеспечили снижение заболеваемости, и, прежде всего, заболеваемости инфекционными болезнями. Все это способствовало укреплению в медицине эмпирического подхода означавшего, что выбор методов диагностики, средств лечения и профилактики болезни должен соответствовать главным образом теоретическим знаниям о причинах возникновения и распространения данной болезни. Только такой подход, по мнению большинства ученых, в значительной степени теоретически и практически гарантировал эффективность применяемых способов диагностики, лечения и профилактики болезней. Однако, следует понимать, что большинство теоретических представлений о болезни всегда будут лишь очередным приближением к истине, поскольку они не могут учесть всего многообразия и изменчивости как людей, так и условий их окружающих. Именно по этому, способы лечения обоснованные лишь теоретически, нередко, как показала клиническая практика, оказывались бесполезными и даже вредными. Кроме того, господствование в медицине эмпирического подхода привело к тому, что практически до средины 20 века в большинстве случаев суждение об эффективности методов диагностики и способов лечения больных основывалось, главным образом, на личном опыте, опыте данного коллектива и мнении авторитета.
Вместе с тем, по данным разных авторов, уже в 15 -16 веке, некоторые ученые поняли, что потенциальная эффективность способов лечения и профилактики болезней, хотя и соответствующих эмпирическим представлениям должна быть обязательно оценена в эксперименте.
Эксперимент (опыт) в общем случае – общенаучный метод проверки причинно-следственных гипотез с помощью вмешательства (контролируемого воздействия) в естественное течение изучаемого явления. Чтобы оценить полученный результат вмешательства, в эксперименте, обязательно участвуют группы сравнения – опытная и контрольная.
Идеальным может считаться опыт, в котором изменяется только один фактор, который воздействует на предмет изучения только в опытной группе. По всем остальным факторам, определяющим результат эксперимента группы сравнения должны быть одинаковы.
К сожалению, на результат медицинских экспериментов влияет не только контролируемое исследователем вмешательство, но и ряд других известных, непонятных, или неизвестных факторов, которые могут существенно повлиять на надежность выводов. Чтобы минимизировать возможные ошибки, необходимо подобрать максимально однородную выборку, из которой затем будут составлены группы сравнения.
Цель эпидемиологических экспериментальных исследований – оценка потенциальнойэффективности средств, способов и схем, предлагаемых для лечения, диагностики и профилактики болезней.
Потенциальная эффективность препаратов, схем, методов лечения и профилактики - это их способность, при качественном исполнении, вызывать позитивные изменения состояния здоровья людей (позитивные эффекты, исходы). Такими позитивными эффектами (исходами) например, являются: снижение летальности, увеличение частоты выздоровления, ремиссий, сокращение периода лечения, предотвращение развития болезни и т.д.
Как уже указывалось, экспериментальная оценка хотя бы приблизительной эффективности начала проводиться в 15-16 веке. При этом исследователь сам отбирал группу лиц, применял какой-либо новый способ лечения или профилактики, сам оценивал результат исследования и сравнивал его с результатами лечения или профилактики традиционными способами, Такие эксперименты впоследствии стали называть неконтролируемыми исследованиями (испытаниями).
Принципиально между словами исследование и испытание существует различие – исследовать (в науке) значит получить новое знание, испытать – проверить в опыте полученное знание. Однако часто испытания приводят к новой информации, поэтому они фактически являются исследованиями. В большинстве публикаций, посвященных эпидемиологическим экспериментам, эти термины используются как синонимы. Сегодня результаты неконтролируемых исследований рассматриваются, в лучшем случае, лишь как ориентировочные, так как на точность и достоверность выводов сильное влияние оказывает, так называемый, «человеческий фактор», в частности желание получить запланированный результат. Поэтому мнения об эффективности уже применяющихся или новых средств нуждаются в надежной проверке.
Однако, к сожалению и в настоящее время значительное число сообщений в российских журналах, Интернете и особенно в различных СМИ основаны на результатах таких неконтролируемых испытаний. При этом результаты исследований являются, по сути дела обыкновенной рекламой, которая может не соответствовать действительной эффективности изученного (рекламированного) средства.
В то же время уже в далеком прошлом исследователи стали понимать, что и в медицинских исследованиях, как и в точных науках, должно неукоснительно соблюдаться основное правило эксперимента – наличие опытной и контрольной группы. Но только в 1897 г. датский врач и ученый Йоханнес Андреас Гриб Фибигер ученик Роберта Коха и Эмиля фон Беринга в ходе работы над докторской диссертацией по дифтерии, провел первое клиническое контролируемое испытание (ККИ) лечебного средства — испытание дифтерийной сыворотки, которою создал Беринг. При этом впервые формирование групп сравнения происходило лишь в незначительной степени случайно – по дате госпитализации больных.
Торвальд Мадсен из Датского государственного института сывороток в Копенгагене первым сообщил о результатах полевых контролируемых испытанийпрофилактического средства - цельноклеточной вакцины против коклюша. Испытание проводилосьво время эпидемии коклюша 1923-1924 гг. на Фарерских о-вах в Северном море. Было установлено, что частота заболеваний коклюшем вакцинированных и невакцинированных была одинаковой, но у вакцинированных болезнь носила намного более умеренный характер, и поэтому смертность в группе получивших вакцину была существенно ниже.
Участие в эксперименте контрольных групп хотя и являлось несомненным достижением экспериментальной медицины, но не оправдало надежд на резкое повышение беспристрастности исследования и точность результатов. Это было связано с тем, что исследователь, подчиняясь только своим научным знаниям и, главное, своим представлением об этике сам формировал опытные и контрольные группы. При этом в опытную группу могли отбирать лиц только с легким течением болезни, что обеспечивало желаемый результат испытания.
Результаты многочисленных контролируемых испытаний сравнительно быстро показали, что необходимо каким-то образом добиться случайного (рандомизированного) деления выборки с тем, чтобы различия между контрольной и опытной группой оказались минимальными. Однако, вначале для рандомизации использовались способы, не обоснованные математически, при этом участники эксперимента делились по дате поступления в стационар, по первой букве фамилии, по номеру страхового полиса и другим псевдослучайным признакам.
Только в первой половине прошлого века знаменитый статистик англичанин Брадфорд Хилл разработал способ, при котором рандомизация (случайное разделение) пациентов по группам была основана на таблице случайных чисел.
История первого применения этого способа связана с выделением в 1943 году в США в лаборатории. Зельмана Ваксмана стрептомицина – как в последствии оказалось мощного средства для лечения многих инфекционных болезней. В течение 1944 - 1945 г. в лаборатории Ваксмана были проведены исследования, которые показали, что стрептомицин активен против туберкулезных бактерий, как пробирке, так и в организме морских свинок зараженных туберкулезом. Через несколько месяцев, клинические испытания на добровольцах также показали способность стрептомицина успешно бороться с туберкулезом человека. В 1947-1948 г. англичане успешно провели первое клиническое контролируемое рандомизированное испытание потенциальной эффективности стрептомицина. При этом рандомизация групп сравнения проводилась с использованием таблиц случайных чисел. Таким образом, 1948 год, когда были опубликованы первые положительные результаты испытания эффективности стрептомицина для лечения туберкулеза, можно считать датой рождения РКИ – клинических рандомизируемых испытаний потенциальной эффективности лечебных средств, в которых рандомизация проводилась с помощью таблиц случайных чисел. Многие специалисты считают эту дату также датой рождения научно обоснованной медицинской практики (доказательной медицины).
В настоящее время стандартом, или как принято говорить «золотым стандартом» дизайна экспериментальных эпидемиологических исследований являются рандомизированные эпидемиологические контролируемые испытания. Чаще всего это название сокращают до «рандомизированные контролируемые испытания». В основе рандомизированных контролируемых испытаний, лежит дизайн когортных исследований.При этом особое формирование опытных и контрольных групп, дозированное контролируемое вмешательство, организация наблюдения и оценка результатов, позволяют избежать тех систематических ошибок, которые встречаются в типичных когортных исследованиях
Большинство специалистов подразделяют рандомизированные контролируемые эпидемиологические эксперименты на:
· рандомизированные контролируемые клиническиеиспытания - когда эксперимент проводится на больных, как правило находящихся в клиниках. При сокращении этого термина чаще используется аббревиатура – РКИ, реже – РККИ.
· рандомизированные контролируемые полевые испытания (строго контролируемые эпидемиологические опыты)- когда в испытании участвует выборка лиц, проживающих на данной территории (общине).
Кроме того, ряд специалистов выделяют общинные интервенционные исследования, когда воздействие производится на общину в целом, например, фторирование водопроводной воды для профилактики кариеса.
Правильно организованные рандомизированные контролируемые испытания по точности и достоверности результатов сравнимы с лабораторными опытами.
Однако проведение экспериментов возможно только при соблюдении положений Конвенции о защите прав человека и человеческого достоинства в связи с применением биологии и медицины. Эта конвенция была принята 19 ноября 1996 г. Парламентской ассамблеей Совета Европы. Этот юридический документ защищает достоинство и индивидуальную целостность человека и гарантирует каждому без исключения соблюдение неприкосновенности личности и других прав и основных свобод в связи с применением достижений биологии и медицины, в том числе в области трансплантологии, генетики, психиатрии и др.
Согласно пятой главе данного документа исследования на людях проводятся только при соблюдении следующих условий:
· не существует альтернативных методов исследования, сопоставимых по своей эффективности;
· риск, которому может быть подвергнут испытуемый, не превышает потенциальной выгоды от проведения данного исследования;
· проект предлагаемого исследования был утвержден компетентным органом после проведения независимой экспертизы научной обоснованности проведения данного исследования, включая важность его цели, и многостороннего рассмотрения его приемлемости с этической точки зрения;
· лицо, выступающее в качестве испытуемого, проинформировано об имеющихся у него правах и гарантиях, предусмотренных законом;
· получено письменное информированное согласие на проведение эксперимента, которое может быть беспрепятственно отозвано в любой момент.
Организаторами (спонсорами) клинического или полевого эксперимента чаще всего являются фармацевтические компании реже сами исследователи. Спонсор несет ответственность за соблюдение принятого дизайна испытания. До начала испытания спонсор должен разработать его протокол, предоставить исследователю полную информацию обо всех результатах доклинических исследований, особенно информацию о побочных эффектах испытуемого лечебного или профилактического препарата, включая список противопоказаний к их применению. Препарат, предоставляемый спонсором, должен быть произведен и упакован в соответствии с существующими стандартами. Страховка пациентов и исследователей также является обязанностью спонсора.
Однако это не означает, что за все ответственны только спонсоры. Именно сами исследователи в первую очередь несут ответственность как за соблюдение дизайна исследования и особенно за здоровье испытуемых. Клинические и полевые испытания могут проводить только врачи, имеющие соответствующую квалификацию и официальное разрешение заниматься врачебной деятельностью.
Дата добавления: 2015-08-14; просмотров: 8903;
