Реальные газы. Модель идеального газа достаточно точно описывает лишь часть экспериментальных данных
Модель идеального газа достаточно точно описывает лишь часть экспериментальных данных. Более точно описывают поведение газов модели реальных газов. В этих моделях учитываются в качестве поправок и конечный объем частиц газа, и взаимодействие между ними.
Уравнение реального газа Ван-дер-Ваалъса для одного моля газа:
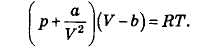
Постоянные а и b характеризуют конкретное вещество и определяются экспериментально. Постоянная а описывает отличие давления газа на стенку при учете взаимодействия между частицами газа от давления идеального газа. Постоянная b характеризует объем, занимаемый собственно частицами газа.
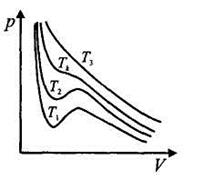 Изотермы газа Ван-дер-Вааль-са изображены на рис. При высоких значениях температуры (Т3) изотермы реального газа близки к изотермам идеального газа. Тк называется критической температурой. При Т = Тк изотерма реального газа имеет лишь точку перегиба. Изотермы реального газа при Т <Тк (например, Т1, или Т2) описывают как газообразное, так и жидкое состояние. При Т > Tk нет таких давлений, при которых существовала бы жидкая фаза.
Изотермы газа Ван-дер-Вааль-са изображены на рис. При высоких значениях температуры (Т3) изотермы реального газа близки к изотермам идеального газа. Тк называется критической температурой. При Т = Тк изотерма реального газа имеет лишь точку перегиба. Изотермы реального газа при Т <Тк (например, Т1, или Т2) описывают как газообразное, так и жидкое состояние. При Т > Tk нет таких давлений, при которых существовала бы жидкая фаза.
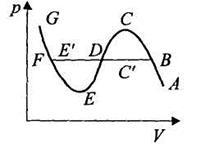 При больших значениях объема (на участке АВ) реальный газ по своему поведению близок к идеальному На участке BC'DE'F сосуществуют жидкая и газообразная фазы. На участке GF изотерма описывает жидкость. Экспериментальная изотерма ABC'DE'FG отличается от изотермы Ван-дер-Ваальса прямолинейным участком. Участок FE описывает перегретую (неустойчивую) жидкость. Участок ВС описывает переохлажденный (неустойчивый) пар. Участки FE и ВС называются также метастабильными состояниями, поскольку присутствие небольших инородных тел приводит к кипению или конденсации.
При больших значениях объема (на участке АВ) реальный газ по своему поведению близок к идеальному На участке BC'DE'F сосуществуют жидкая и газообразная фазы. На участке GF изотерма описывает жидкость. Экспериментальная изотерма ABC'DE'FG отличается от изотермы Ван-дер-Ваальса прямолинейным участком. Участок FE описывает перегретую (неустойчивую) жидкость. Участок ВС описывает переохлажденный (неустойчивый) пар. Участки FE и ВС называются также метастабильными состояниями, поскольку присутствие небольших инородных тел приводит к кипению или конденсации.
Дата добавления: 2015-08-14; просмотров: 825;
