Карбамид, мочевина Меламин
Карбамид(мочевина) СО(NH2)2 - диамид угольной кислоты, представляет собой белые кристаллические гранулы с температурой плавления 132,7°С и плотностью 1330 кг/м3.
Водные растворы карбамида имеют нейтральную реакцию на лакмус, но наличие МН2-групп обусловливает слабый основной характер органические и неорганические кислоты образуют с ним соли.
Меламин (цианурамид, триаминотриазин) представляет собой белый кристаллический порошок с температурой плавления 354 °С и плотностью 1570 кг/м3, плохо растворимый в воде. Меламин - слабое основание , но более сильное, чем мочевина; его водные растворы имеют слабощелочную реакцию; с кислотами он образует соли. Меламин хорошо растворяется в водных растворах едкого натра и едкого калия, хуже — в воде (5 % при 100 °С).
Анилин(С6Н5NH2) маслянистая жидкость с температурой кипения 184°С, токсичен, плохо растворим в воде является слабым основанием, с кислотами образует соли.
Формальдегид (муравьиный альдегид) СН2 О - газообразное вещество со своеобразным острым запахом (температура кипения 21 °С). Формальдегид легко растворяется в воде (растворы называются формалином) и спиртах.
Формалин выпускают с содержанием формальдегида 36,5-37,5 % и содержанием метанола 4-8 %.
ГексаметилентетраминГМТА (уротропин, гексамин) (СН2)6Н4 - белый кристаллический порошок, легко растворяющийся в воде. ГМТА - слабое органическое основание, но более сильное, чем мочевина; с кислотами образует соли.
Особенности взаимодействия карбамида и меламина с формальдегидом.
Карбамидоформальдегидные смолы. В щелочной среде (рН 11-13) из карбамида и формальдегида независимо от соотношения компонентов образуется монометилолкарбамид:
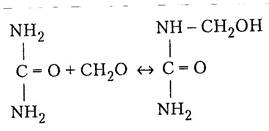
В случае проведения реакции в нейтральной или слабощелочной среде (рН 7-8) карбамид с формальдегидом в зависимости от исходного соотношения компонентов и температуры также образует моно- и диметилолкарбамид.
При 20-50 °С и мольном отношении карбамид: формальдегид = 1:1 образуется монометилолкарбамид, который при более высокой температуре превращается в смолу линейного строения. При 20-75 °С и мольном отношении карбамид: формальдегид = 1:2 образуется диметилолкарбамид:

Процесс протекает в две стадии: сначала из карбамида и формальдегида получается монометилолкарбамид, а затем более медленно присоединяется вторая молекула формальдегида и образуется диметилолкарбамид.
Монометилолкарбамид — белое кристаллическое вещество, плавящееся после перекристаллизации из спирта при 111 °С. Оно растворяется в холодной воде и метиловом спирте.
Диметилолкарбамид после перекристаллизации из 80 %-ного спирта плавится при 126 °С. При 137-138 °С расплавленный продукт отщепляет воду и формальдегид и затвердевает, превращаясь в аморфное вещество, разлагающееся без плавления при 260 °С. Диметилолкарбамид хорошо растворяется в воде (400 г/л по сравнению с 150 г/л монометилолкарбамида) и при нагревании в метиловом и этиловом спиртах.
В слабокислой среде (рН 5-6,5) из карбамида и формальдегида при избытке формальдегида образуются низкомолекулярные смолы (олигомеры), молекулярная масса которых определяется температурой и продолжительностью реакции поликонденсации.
Из монометилолкарбамида образуются только линейные олигомеры.
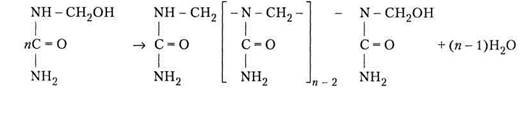
В общем виде:
|
В общем виде образование карбомидоформальдегидных смол при мольном соотношении карбамид: формальдегид =1:1 может быть представлено схемой:
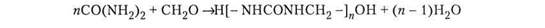
Из диметилолкарбамида могут образовываться как линейные смолы, так и смолы с циклическими звеньями.
Неотвержденные карбамидоформальдегидные смолы (КФС) представляют собой смеси молекул небольшой молекулярной массы (олигомеров). Из-за высокой реакционной способности компонентов и разнообразия направлений реакции поликонденсации возможно приготовление смол различного линейного и разветвленного строения. Основной их особенностью является присутствие метилольных групп, способных к дальнейшей поликонденсации. Содержание метилольных групп в смоле тем выше, чем больше участвовало в реакции формальдегида. В общем виде КФС имеют следующее строение:
nСО(NН2)2 + (п + 1) СН2О ®
®Н[- NНСОNН - СН2 -] - [- N(СН2ОН)СОNН -](n - 1) - СН2ОН + nН20
В сильнокислой среде (рН 1-4) карбамид с формальдегидом, взятые в мольном отношении 1 : 1 или 1:2, быстро вступают в реакцию и образуют аморфные, нерастворимые продукты. Скорость реакции поликонденсации растет с повышением кислотности среды. Строение их аналогично полимерным метиленмочевинам общей формулы:
[- NH - CO - NH - CH2 -]n
Нагревание их водных растворов в нейтральной, слабокислой или слабощелочной среде приводит к образованию смол, растворимых в воде.
Если нейтральная и слабощелочная среды более благоприятны для образования метилольных производных, то слабокислая среда — для получения смол, а сильнокислая - для их отверждения. Вязкость водного раствора смолы увеличивается по мере увеличения продолжительности и повышения температуры конденсации. Удаление при атмосферном или пониженном давлении части воды также приводит к увеличению вязкости раствора. Кроме воды, в которой растворимы продукты поликонденсации карбамида и формальдегида, при получении смол в производстве лаков и красок находят применение и другие растворители (например, бутиловый спирт).
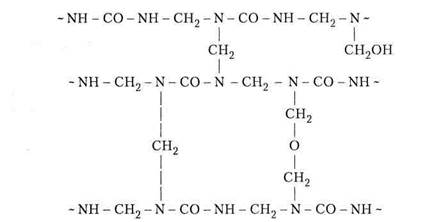
Отверждение КФС происходит лишь в том случае, если они содержат свободные метилольные группы. Процесс взаимодействия молекул сопровождается выделением воды и формальдегида и образованием поперечных связей между молекулами. Чем больше метилольных групп в смоле, тем выше плотность сшивки молекул и лучше качество отвержденного продукта.
Образование сшитых КФС можно представить схемой:
|
Плотность поперечных связей между молекулами в отвержденных КФС невелика. Изучение процесса отверждения показало, что оно протекает через три стадии. В стадии А смола представляет собой вязкую жидкость, легко растворимую в воде. Температура стеклования ее не ниже -5 °С. В стадии Б смола представляет собой рыхлое, набухшее в воде, студнеобразное тело, переходящее при дальнейшем нагревании в более плотное состояние. В стадии В смола представляет собой твердое и плотное вещество, нерастворимое и неплавкое.
Переход смолы из стадии А в стадию Б сопровождается ухудшением растворимости в воде, низших спиртах и глицерине. В этом состоянии смола скорее всего представляет собой линейный полимер, составленный из более длинных (по сравнению с исходной смолой) цепей. При переходе смолы в стадию В происходит выделение 20-25 % воды и потеря растворимости. Отвержденная смола набухает в воде, спирте, формалине и глицерине. Набухание показывает, что число поперечных связей в ней невелико. Этот вывод подтверждается малой стойкостью отвержденной смолы к горячей воде и водным растворам кислот, а также легкостью деструкции при нагревании (с небольшим выходом кокса).
Меламиноформальдегидиые смолы (МЛФС). Эти смолы получают из меламина и формальдегида. Закономерности их образования и отверждения близки к закономерностям образования и отверждения карбамидоформальдегидных смол.
Присоединение формальдегида к меламину протекает с заметной скоростью уже при 40 °С. При этом образуются метилольные производные. Наиболее благоприятной является нейтральная или слабощелочная среда (рН 7-8,5). Легко присоединяются лишь три моля формальдегида на один моль меламина - образуется триметилолмеламин. Следующие три моля присоединяются в более жестких условиях (при значительном избытке формальдегида и температуре выше 80 °С), причем в процессе реакции можно выделить тетра-, пента- и гексаметилолмеламин.
Метилольные производные меламина хорошо растворяются в горячей воде, но быстро осаждаются в виде кристаллических продуктов при охлаждении растворов
Конденсация метилольных групп меламина происходит в слабощелочной, нейтральной и кислой средах. Метиленовые и простые эфирные связи возникают за счет метилольных групп и процесс образования смолы сопровождается выделением воды.
На стадии образования низкомолекулярных МЛФС их строение в общем виде можно записать следующим образом:
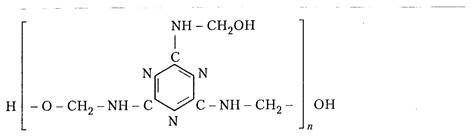
Число простых эфирных связей начинает возрастать при температуре выше 130 °С, однако при 150—180 °С вследствие выделения формальдегида образующиеся диметиленэфирные группы превращаются в метиленовые:
-СН2-О-СН2- ® -СН2- + СН2О
В кислой среде метилолмеламин реагирует со спиртами, образуя эфиры - кристаллические вещества, превращающиеся при нагревании в присутствии воды в неплавкие и нерастворимые смолы. Процесс сопровождается отщеплением спирта и формальдегида; ускорителями служат кислоты и соли сильных кислот (хлориды аммония, цинка и др.).
При хранении водных растворов МЛФС наблюдается медленное возрастание вязкости, что указывает на дальнейшее протекание реакции конденсации. Этот процесс может проходить до превращения раствора в прозрачный или просвечивающий гель, характеризующийся наличием поперечных связей в смоле.
Длительное хранение растворов смолы, повышение температуры и снижение рН среды приводят к гелеобразованию. Его можно предотвратить повышением рН растворов смолы до 9,0-9,5, например, добавлением небольших количеств буры (0,05-2,0 % по отношению к смоле).
При высокой температуре (130-150 °С) и в присутствии кислого катализатора отверждение МЛФС происходит быстро. Повышенная по сравнению с мочевиной функциональность меламина определяет образовение в смоле большого числа поперечных связей. МЛФС обладают лучшими, чем МФО, водо- и теплостойкостью, твердостью и блеском.
Дата добавления: 2015-08-14; просмотров: 4545;
