ХИМИЧЕСКИЕ СВОЙСТВА ВОЛЬФРАМА
При комнатной температуре вольфрам стоек к атмосферной коррозии, но при нагреве уже до 750 К окисляется до WO3, реагирует с галогенами: с фтором – при комнатной температуре, а йодом при температуре около 900 К.
При нагреве высоких температур он реагирует с углеродом, кремнием и бором, образуя соответственно карбиды,силициды,бориды. Сера и фосфор в обычных условий на вольфрам не действуют. На воздухе растворяется в горячих водных растворах щелочей, но слабо поддается действию кислот, кроме плавиковой и азотной при нагреве.
Водород и азот не дают химических соединений с вольфрамом,в плоть до
30000 С, хотя в некоторых источниках имеются указания на возможность образования гидрида WH2.
Cкислородом вольфрам образует три устойчивых оксида:
-WO2 – бурового цвета;
- WO3 – желтого цвета;
- W2O5 – синеватого цвета.
Все эти оксиды образуются при температуре около 800 К на воздухе или в кислороде, причем все они очень летучи, имеют невысокую температуру плавления. Например, WO3 плавится при температуре 1645 К.
На практике, чтобы отличить вольфрамовую проволоку, от молибденовой пользуются простым приемом: кончик проволоки поджигают спичкой. Если при этом наблюдается желтый или бурый дымок, значит, это проволока вольфрамовая, если белый – молибденовая.
Углерод восстанавливает оксиды W:
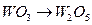 при температуре 825 К;
при температуре 825 К;
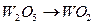 при температуре 1325 К;
при температуре 1325 К;
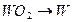 при температуре 1425 К.
при температуре 1425 К.
С азотом вольфрам образует нитриды при температурах более 1600 К, но выше отметки 2275 К они разлагаются.
При взаимодействии с углеродом и температурах выше 1800 К вольфрам образует карбиды W2CиWC. ПлотностьW2C – 16000 кг/м3, WC– 9000 кг/м3, твердость около 9 единиц по Мосу. При температуре 2875 К кабрид WC разлагается по реакции
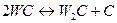
На рис.73 приведена диаграмма состояния W–C.
Как видно из диаграммы, карбиды вольфрама имеют температуру плавления значительно ниже таковой для самого металла. Так, WC плавится при температуре около 2875 К, W2C – 3065 К. Кроме того, карбиды могут образовывать с вольфрамом эвтектические сплавы с температурой плавления значительно низшей чем у металла, который плавится при 3683 К. Поэтому нужно обратить внимание ракетчиков на опасность реакции образования карбидов на границе графит – вольфрам, которая имеет место при нагреве выше 2675 К. Предупреждение связано с тем, что в конструкции вкладыша критического сечения сопла твердотопливного двигателя сочетаются вольфрамовая внутренняя облицовка с графитовой обоймой.
Во избежание приведенной реакции между вольфрамовой облицовкой и графитом обоймы наносится так называемый «барьерный» слой из карбида тантала или титана (ТаС, TiC).
В связи с высокой плотностью вольфрама и его дефицитностью конструкторы и технологи стремятся заменить его на более легкие и менее дефицитные материалы, о чем будет сказано далее.


Рис. 73. Диаграмма состояния W-C
Рис. 74. Схема массопереноса в лампе
накаливания:1 –стенка колбы, где образуется WJ2; 2 –спираль, где WJ2 разлагается на W и J
Хотя реакция вольфрама с йодом не имеет отношения к ракетной технике, все же на ней хотелось бы коротко остановиться.
При температуре выше 850 К вольфрам с парами йода образует иодид, который представляет собой легко сублимирующую соль йодидной кислоты:
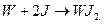
При температуре2475 К йодид разлагается:
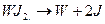
Эти две реакции используются для переноса вольфрама, например, в лампах накаливания: несмотря на низкую упругость паров в них вольфрам все же испаряется в вакууме. Пары его садятся на стенки стеклянной колбы лампы и прозрачность ее уменьшается. Если колбу заполнить парами йода, то последний станет реагировать с вольфрамом на горячей стенке лампы и образует WJ2, который за счет диффузии попадает на нагретую вольфрамовую спираль и разложится. Свободный йод снова переместиться к стенке, а вольфрамостанется на спирали, и так без конца. В конечном результате повышается светимость и долговечность йодозаполненных ламп.
Эта же реакция используется в технике для получения чистых тугоплавких металлов: вольфрама, тантала, молибдена, гафния и др.
Эту реакцию можно использовать и для получения тонких оболочек из вольфрама. Кроме йодидного метода для этой цели можно использовать карбонильный, т.е. разложение WCO2. В реактивных топливныхдвигателях вольфрам в чистом виде, как правило, не применяется ввиду низкой термической стойкости, а применяется в виде так называемых псевдосплавов с медью. Об этом будет сказано ниже.
В ядерной технике вольфрам может применяться в качестве плакирующего слоя ТВЭЛов на основе UC–ZrC повышения их прочности, уменьшения испарения и распухания. Он может входить в состав металлокерамических элементов типа
W - UC или W – UO2 и т.п. Такие ТВЭлы могут работать при температуре до 2000 К, так как вольфрам, несмотря на многие недостатки, является жаропрочным металлом, медленно испаряется и защищает от осколков деления и излучений. В разделе «Углеродные материалы» вольфрам рассматривается, как армирующий материал в углеметаллопластиках, которые применяются для изготовления узлов и деталей РДТТ, работающих в жестких условиях высоких температур и высокоскоростных газовых потоков.
Дата добавления: 2015-07-10; просмотров: 4416;
