Закон действующих масс
Поведение в водном растворе каких-либо веществ, вступающих между собой в реакцию, управляется константой равновесия, отвечающей отношению произведения концентрации реагирующих веществ к произведению концентраций продуктов реакции, т. е. если в исследуемом растворе А + В = Y + X, то количества этих веществ будут отвечать уравнению:
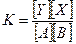 (7.1)
(7.1)
где К — константа равновесия.
В более общем виде:
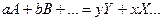 (7.2)
(7.2)
и
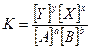 (7.3)
(7.3)
где а, b, у, х — число молекул соответствующих соединений, участвующих в реакции. Так, например, рассматривая реакцию образования хлористого водорода Н2 + С12 = 2НС1, можно записать:
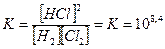
7.3.Правило Ле-Шателье
Это правило гласит: если какой-либо внешний фактор воздействует на равновесную систему, эта система в свою очередь активизирует процесс, противодействующий подобному эффекту. Так, например, при охлаждении системы в ней будут протекать реакции, сопровождающиеся выделением тепла; при повышении давления возникнут минералы большей плотности (при увеличении давления на лед он будет расплавляться, превращаясь в воду, так как при этом плотность воды будет возрастать до 1,00 г/см3 по сравнению со льдом - 0,92 г/см3).
Весьма распространена реакция так называемого волластонитового равновесия: СаСO3 +SiO2 = CaSiO3 + СО2, которая при значительном увеличении давления не может протекать, так как давление препятствует образованию газообразной фазы СO3.
7.4. Величина рН
Растворенная в воде HCI полностью диссоциирует:
НС1→ Н+ + С1-.
То же самое происходит с NaOH:
NaOH→OH- + Na+.
При их слиянии в эквивалентных количествах произойдет нейтрализация раствора, определяемая тем, что Н+ + ОН- = Н20.
Однако вода, отвечающая нейтральным условиям, сама может в незначительной степени диссоциировать: н2о=он-+н+
причем
Кн2о = [Н+][ОН-] = 10-14;
откуда
[Н+]=10-7, а [ОН-] = 10-7.
Отрицательный логарифм концентрации водородных ионов обозначается через рН и служит показателем меры концентрации водородных ионов в растворе: рН= 0 отвечает раствору сильной кислоты, рН = 14 — раствору щелочей, рН = 7 — нейтральной среде. Для речных вод характерна величина рН = 5÷6,5, почвенные воды и воды торфяных болот отличаются еще более кислой реакцией, за счет органических кислот (рН = 3,5-4), в то время как в водах океана рН = 8,1÷8,3. В некоторых бессточных озерах пустынь рН достигает за счет щелочного резерва (СаСO3) 9-10. Гидраты окислов ряда элементов выпадают в осадок в строгой зависимости от величины рН. Так, например, А1 (ОН)3 выпадает при рН = 4 и затем может растворяться снова при рН = 10; Fe (ОН)3 всегда осаждается при рН = 3, в то время как Fe (OH)3 удерживается в растворе до рН = 5,5; Мn (ОН)4 осаждается лишь при рН = 8,5÷8, в то время как Zn (ОН)2, Сu (ОН)2, Рb (ОН)2, Ni (ОН)2 выпадают в интервале рН = 5,2÷6.5
С последним обстоятельством связано накопление марганца в виде конкреций на дне океана вдали от области его выноса и сравнительно большие скопления халькофильных элементов в осадках, отличавшихся обилием органического материала в прибрежных частях океана.
Мы можем утверждать, таким образом, что рН природных вод оказывается мощным фактором, регулирующим миграцию и осаждение многих соединений в земной коре. В то же время сама величина рН в значительной степени регулируется концентрацией в водах СО2 и H2S — продуктов жизнедеятельности организмов.
Дата добавления: 2015-08-14; просмотров: 1076;
