Правило фаз
Правило фаз является одним из основных положений термодинамики, впервые предложенных Виллардом Гиббсом. Оно устанавливает связь между числом степеней свободы системы (температуры, давления, концентрации) F, числом компонентов, участвующих в системе, С и числом образующихся из них фаз Р.
Как известно, это выражение определяется следующей форлой:
F=C-P+2 (7.3)
Рассмотрим некоторые примеры, вытекающие из этого правила.
|
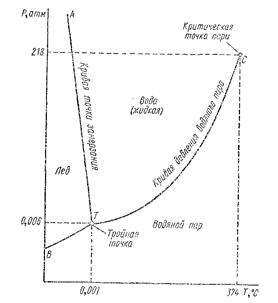
Однокомпонентнан система—вода. На рис. 7.2 в координатах Р и Т изображены три состояния воды при температуре от 0 до 374° С (критическая температура воды) и давлении от 0 до 218 атм. Если мы выберем точку в одном из полей, отвечающих стабильности одной из фаз воды, например в верхнем правом поле, соответствующем условиям существования жидкой воды, то перемещение ее в сравнительно большем диапазоне давления и температуры будет отвечать тому же состоянию воды.
Рис. 7.2. Диаграмма состояний воды при данных давлениях и температурах (по К. Краускопфу).
Тогда, подставив в уравнение (7.3) значения С = 1 и Р = 1 (один компонент и одна фаза), получим F – 1- 1+2 = 2, т. е. рассматриваемая система будет обладать двумя степенями свободы - в пределах достаточно большого диапазона давлений и температур она сможет изменяться без видимых искажений.
Если бы точка переместилась на одну из пограничных линий -ТА или ТС, в системе наряду с жидкой водой появились либо лед (в первом случае), либо пар (во втором случае). Тогда уравнение (7.3) будет выглядеть иначе:
F = 1 - 2 + 2=1,
вместо одной будут присутствовать две фазы и число степеней свободы сократится до одной (возникнет моновариантная система). Следовательно, кривые AT, СТ и ВТ будут отвечать двухфазовым системам, в которых независимой переменной может служить либо температура, либо давление.
Когда точка совпадает с точкой Т, характеризующейся одновременным присутствием воды, льда и пара, уравнение примет следующий вид:
F = 1- 3 + 2 = 0,
т. е. в данной точке возможно присутствие трех фазовых состояний воды лишь при условии, что система будет инвариантной: ни давление, ни температура в ней изменяться не смогут. При отклонении одной из них точка начнет перемещаться по трем кривым, пересекающимся в точке Т. Но это произойдет лишь в том случае, если температура и давление будут изменяться взаимосвязанно. Если же произойдет отклонение их независимо друг от друга, то точка перейдет снова в первоначальное положение, отвечающее дивариантной системе равновесия.
Двухкомпонентная система — раствор соли CaSO4. Рассмотрим поведение раствора, содержащего, например, в растворенном состоянии CaSO4, способного образовывать две фазы — ангидрит и гипс. Всего же рассматриваемая система будет способна создавать пять фаз: ангидрит, гипс, раствор, лед и пар.
Очевидно, на рис. 7.3 должна была появиться еще одна координата — концентрация CaSO4, поскольку поведение раствора выражалось бы в смещении точки замерзания по отношению к Т в область более высоких температур в зависимости от концентрации раствора.
Очевидно, тогда линия, соединяющая точки Т и Т1 на подобном чертеже, означала бы одновременное присутствие трех фаз—льда, пара и жидкости, которые могли бы существовать на всем протяжении подобной кривой, т. е. имели бы одну степень свободы. Для того чтобы получить инвариантную систему, лишенную степеней свободы, мы должны были бы охладить систему настолько, чтобы появилась четвертая фаза — соль.
По-видимому, на такой трехмерной диаграмме поверхности ее означали бы двухфазовые равновесия, линии — трехфазовые. И, вероятно, была бы одна точка, отвечающая четырехфазовому равновесию. Очевидно, что равновесие, включающее в себя все пять фаз, участвующих одновременно в системе, невозможно.
Итог подобных рассуждений изложен в табл. 7.2.
В. Гольдшмидт, изучая скарны Южной Норвегии, обратил внимание на то, что наблюдаемые им парагенезисы минералов были тем пестрее, чем больше содержали они компонентов. Это послужило ему основанием применить правило фаз Гиббса. Рассуждал В. Гольдшмидт так: для широкого круга минералов возможны по крайней мере две степени свободы — давление и температура. Следовательно, известная формула F = С - Р + 2, если F = 2, примет вид:
Р = С.
Таблица 7.2
Возможные равновесия в системе вода — соль
| Система | Число компонентов (C) | Число фаз (P) | Число степеней свободы (F) |
| Вода | |||
| Вода-соль | |||
| Вода – гипс- ангидрит | |||
| Не возможно |
Иначе говоря, число минералов (фаз) равно числу участвующих в данном парагенезисе компонентов. Чем больше, участвует компонентов, тем большее число минералов может при этом одновременно присутствовать.
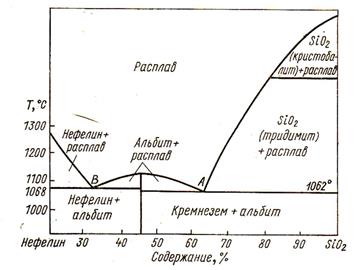
Рис. 7.3. Диаграмма состав — температура для системы нефелин — кремнезем (по Т. Барту).
Так, например, для случая кремнезем—нефелин возможны две ассоциации: кварц + альбит и альбит + нефелин. Парагенезис из всех трех минералов маловероятен. Если рассматривать эту же систему в стадии кристаллизации из расплава (рис. 7.3), то в момент, когда расплав будет отвечать точке А, и до момента достижения системою эвтектики В в ней будет существовать лишь альбит и меняющийся по своему составу расплав. Когда, наконец, температура снизится до 1068°, расплав исчезнет, а вместо него будут присутствовать две минеральные фазы - альбит и нефелин. Если начальный состав расплава был более кислым, возникнет ассоциация альбита и кварца.
Дата добавления: 2015-08-14; просмотров: 1073;
