Карбонатные равновесия
Карбонат кальция (кальцит) - один из очень распространенных и важных минералов. Его судьба отражает сложные процессы, вызвавшие изменения в земной коре, особенно связанные с концентрацией углекислоты в гидросфере. Рассмотрим некоторые особенности его поведения в природе.
Повышение кислотности растворов всегда приводит к растворению в нем карбоната кальция:
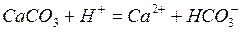
и, наоборот, увеличение щелочности нейтрализует предыдущую реакцию:
Са2+ +НСO3- +ОН- =СаСO3+Н2O.
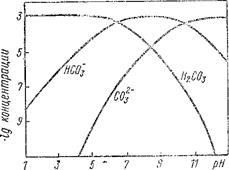
На рис. 7.1 показана зависимость концентрации углекислоты и продуктов ее диссоциации от рН растворов. Суммарная концентрация Н2С03 равна 0,001 М. График дает представление о причинах растворения кальция в кислых условиях при избытке НСО3 и его осаждения в виде кальцита при избытке ионов 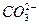 .
.
Для углекислоты характерны две ступени диссоциации:
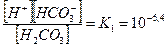 , (7.1)
, (7.1)
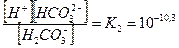 (7.2)
(7.2)
|
Рис. 7.1. Концентрация продуктов диссоциации углекислоты при 25° С в растворах при общем количестве растворенной углекислоты 0,001 М.
Вода, соприкасающаяся с атмосферой, имеет рН = 6,4 за счет Н+ ионов, присутствующих в ней в результате равновесия с углекислотой атмосферы. Однако наибольшее значение приобретает растворенный в морской воде карбонат кальция. В этом случае добавление кислоты приводит к реакции
H++HCO3-=H2CO3,
а добавление щелочи — к реакции
H2CO3+OH-=HCO-3+H2O.
Добавление 3 мл 1М NaOH в морскую воду изменит рН только пределах 8±0,5, в то время как рН дистиллированной воды достигает 11,5. Это показывает, что углекислота, присутствующая в морской воде в виде бикарбоната, играет роль буфера, поддерживающего рН морской воды достаточно постоянным, несмотря на колебания концентраций в ней различных солей.
Дата добавления: 2015-08-14; просмотров: 2362;
