Окисленная форма восстановленная форма. Сr2O72- нейтральная среда (рн » 7)

 кислая среда (рн < 7)
кислая среда (рн < 7)

 Cr3+ зеленая окраска
Cr3+ зеленая окраска
раствора
Сr2O72- нейтральная среда (рн » 7)
 Сr(OН)3 (серо-голубой осадок)
Сr(OН)3 (серо-голубой осадок)
СrO42-
|
В щелочной среде ион [Сr(OН)6]3- окисляется до иона СrO42-.
Примеры:
1. Составить молекулярное уравнение для процесса
Na2SO3 + K2Cr2O7 + H2SO4 ®
Решение.
Ионно-молекулярная схема процесса
SO32- + Cr2O72- + 2H+ ® SO42- + Cr3+ + …
в-ль ок-ль среда продукт продукт
ок-ния в-ния
Уравнения полуреакций и ионно-молекулярное уравнение будут:

 3 SO32- +H2O – 2e- = SO42- + 2H+
3 SO32- +H2O – 2e- = SO42- + 2H+
1 Cr2O72- + 14H+ + 6e- = 2Cr3+ +7H2O

3SO42- + Cr2O72- + 8H+ = 3SO42- + 2Cr3+ + 4H2O
Молекулярное уравнение процесса:
3 Na2SO3 + K2Cr2O7 + 4H2SO4 =3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O.
Пример 2. Составить молекулярное уравнение для процесса в щелочной среде:
Na3 [Cr(OH)6] + H2O2 + NaOH ®
Решение.
Ионно-молекулярная схема процесса:
[Cr(OH)6]3- + H2O2 + OH  ® CrO42- + ОН
® CrO42- + ОН 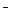 + …
+ …
в –ль ок-ль среда продукт продукт
ок-ия в-ния
Уравнения полуреакций и ионно-молекулярное уравнение будут:

 2 [Cr(OH)6]3- + 2OH
2 [Cr(OH)6]3- + 2OH 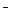 - 3e- = CrO42- + 4H2O
- 3e- = CrO42- + 4H2O
3
| |
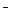

2[Cr(OH)6]3- + 3H2O2 = 2CrO42- + 2OH 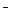 + 8H2O
+ 8H2O
Молекулярное уравнение:
2Na3[Cr(OH)6] + 3H2O2 = 2Na2CrO4 + 2NaOH + 8 H2O.
Часто на протекание процесса оказывают влияние концентрация раствора и температура. Так, реакция взаимодействия хлора с разбавленным раствором щелочи при комнатной температуре протекает с образованием гипохлоритов и хлоридов:
CI2 + 2NaOH = NaCIO +NaCI + H2O.
При нагревании до 100 0С в присутствии концентрированного раствора щелочи та же реакция протекает с образованием хлоратов и хлоридов:
3CI2 + 6NaOH = NaCIO3 +5NaCI + 3H2O.
На характер протекания реакции может оказывать влияние и катализатор. В присутствии такого катализатора, как иодид-ион I 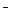 , реакция между Na2S2O3 и Н2О2 протекает по уравнению
, реакция между Na2S2O3 и Н2О2 протекает по уравнению
2Na2S2O3 + Н2О2 = Na2S4O6 + 2NaOH.
В присутствии же другого катализатора – молибденовой кислоты H2MоO4 –та же реакция протекает по уравнению
Na2S2O3 + 4Н2О2 =Na2SO4 + Н2SO4 + 3H2O.
Как следует из рассмотренных примеров, на направление и скорость ОВР влияют многие факторы: природа реагирующих веществ, характер среды, концентрация раствора, температура, присутствие катализатора.
Дата добавления: 2015-08-11; просмотров: 1049;
