Окисленная форма восстановленная форма
кислая среда Mn2+ б/ц или слабо-розовая

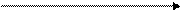 рн < 7 окраска р-ра
рн < 7 окраска р-ра
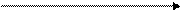 +7 нейтральная среда +4
+7 нейтральная среда +4
MnO 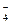 рн » 7 MnO2 (бурый осадок)
рн » 7 MnO2 (бурый осадок)
+6
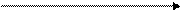 щелочная среда (MnO4)2- (зелёная окраска
щелочная среда (MnO4)2- (зелёная окраска
рн > 7 раствора)
Перманганат–ион окислительные свойства в большей степени проявляет в кислой среде (большее понижение степени окисления).
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную (хлороводородную) кислоты применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксида калия или натрия.
Рассмотрим примеры влияния среды на течение реакции с участием пероксида водорода. Пероксид водорода в зависимости от среды восстанавливается согласно схеме:
кислая среда pн< 7
 H2O2 + 2H+ + 2e- = H2O
H2O2 + 2H+ + 2e- = H2O
 H2O2
H2O2
 нейтральная среда
нейтральная среда
щелочная среда H2O2 + 2e- = 2OH-
Здесь H2O2 выступает как окислитель. Например:
 2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2 H2O
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2 H2O
 2 Fe2+ - e- = Fe3+
2 Fe2+ - e- = Fe3+
 1 H2O2 + 2H+ + 2e = 2 H2O
1 H2O2 + 2H+ + 2e = 2 H2O
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2 H2O
Однако, с очень сильным окислителем, таким, как KMnO4, пероксид водорода взаимодействует как восстановитель:
H2O2 - 2e- = O2 + 2H+
Например:
5 H2O2 + 2 KMnO4 + 3H2SO4 = 5 O2 + 2 MnSO4 + K2 SO4 + 8H2O

 5 H2O2 - 2e- = O2 + 2H+
5 H2O2 - 2e- = O2 + 2H+
 2 MnO-4 + 8H+ + 5e = Mn2+ + 4H2O
2 MnO-4 + 8H+ + 5e = Mn2+ + 4H2O
5 H2O2 + 2 MnO-4 + 6H+ = 5 O2 + 2 Mn2+ + 8H2O
Хром в своих соединениях имеет устойчивые с.о. (+6) и (+3). В первом случае соединения хрома (хромат-, дихромат-ионы) проявляют свойства окислителей, во втором – восстановителей. Хромат и дихромат-ионы – сильные окислители, восстанавливаются до соединений Cr3+:
Дата добавления: 2015-08-11; просмотров: 1132;
