Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
Данный метод учитывает среду раствора, дает представление о характере частиц реально существующих и взаимодействующих в растворах. Остановимся на нем более подробно.
Алгоритм подбора коэффициентов в уравнениях ОВР методом ионно-электронного баланса:
1. Составить молекулярную схему реакции с указанием исходных веществ и продуктов реакции.
2. Составить полную ионно-молекулярную схему реакции, записывая слабые электролиты, малорастворимые, нерастворимые и газообразные вещества в молекулярном виде, а сильные электролиты – в ионном.
3. Исключив из ионно-молекулярной схемы ионы, не изменяющиеся в результате реакции (без учета их количества), переписать схему в кратком ионно-молекулярном виде.
4. Отметить элементы, изменяющие в результате реакции степень окисления; найти окислитель, восстановитель, продукты восстановления, окисления.
5. Составить схемы полуреакций окисления и восстановления, для этого:
а) указать восстановитель и продукт окисления, окислитель и продукт восстановления;
б) уравнять число атомов каждого элемента в левой и правой частях полуреакций (выполнить баланс по элементам) в последовательности: элемент, изменяющий степень окисления, кислород, другие элементы; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы Н2О, ионы Н+ или ОН – в зависимости от характера среды:
| Процесс | Кислая среда | Нейтральная среда | Щелочная среда |
| Связывание избытка кислорода | О-2+2Н+ =Н2О | О-2+Н2О=2ОН ˉ | О-2+Н2О=2ОН ˉ |
| Восполнение недостатка кислорода | Н2О= О-2+2Н+ | Н2О = О-2+2Н+ | 2ОН ˉ=О-2+Н2О |
в) уравнять суммарное число зарядов в обеих частях полуреакций; для этого прибавить или отнять в левой части полуреакций необходимое число электронов (баланс по зарядам).
6. Найти наименьшее общее кратное (НОК) для числа отданных и полученных электронов.
7. Найти основные коэффициенты при каждой полуреакции. Для этого полученное в п.6 число (НОК) разделить на число электронов, фигурирующих в данной полуреакции.
8. Умножить полуреакции на полученные основные коэффициенты, сложить их между собой: левую часть с левой, правую – с правой (получить ионно-молекулярное уравнение реакции). При необходимости “привести подобные” ионы с учетом взаимодействия между ионами водорода и гидроксид-ионами: H++OH ˉ= H2O.
9. Расставить коэффициенты в молекулярном уравнении реакции.
10. Провести проверку по частицам, не участвующим в ОВР, исключенным из полной ионно-молекулярной схемы (п.3). При необходимости коэффициенты для них находят подбором.
11. Провести окончательную проверку по кислороду.
Примеры:
1. Кислая среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + H2O + K2SO4
Полная ионно-молекулярная схема реакции:
K++MnO 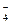 + Na++NO
+ Na++NO 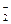 +2H++ SO
+2H++ SO 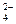 ® Mn2+ + SO
® Mn2+ + SO 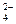 + Na+ + NO
+ Na+ + NO 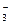 + H2O + 2K+ +SO
+ H2O + 2K+ +SO 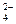 .
.
Краткая ионно-молекулярная схема реакции:
+7 +3 +5
MnO 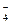 +NO
+NO 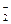 +2H+ ® Mn2+ + NO
+2H+ ® Mn2+ + NO 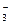 + H2O
+ H2O
ок-ль в-ль прод.в-ния прод.ок-ия
В ходе реакции степень окисления Mn понижается от +7 до +2 (марганец восстанавливается), следовательно, MnО 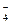 – окислитель; Mn2+ – продукт восстановления. Степень окисления азота повышается от +3 до +5 (азот окисляется), следовательно, NO
– окислитель; Mn2+ – продукт восстановления. Степень окисления азота повышается от +3 до +5 (азот окисляется), следовательно, NO 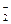 – восстановитель, NO
– восстановитель, NO 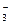 – продукт окисления.
– продукт окисления.
Уравнения полуреакций:

 2 НОК MnO
2 НОК MnO 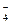 + 8H+ + 5e- ® Mn2+ + 4H2O – процесс восстановления
+ 8H+ + 5e- ® Mn2+ + 4H2O – процесс восстановления
10 +7 +(-5) = +2
5 NO 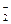 + H2O – 2e- ® NO
+ H2O – 2e- ® NO 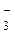 + 2H+ – процесс окисления
+ 2H+ – процесс окисления
-1 -(-2) = +1
 2MnO
2MnO 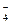 + 16H+ + 5NO
+ 16H+ + 5NO 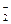 + 5H2O = 2Mn2+ +8H2O + 5NO
+ 5H2O = 2Mn2+ +8H2O + 5NO 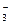 + 1OH+ (полное ионно-молекулярное уравнение).
+ 1OH+ (полное ионно-молекулярное уравнение).
В суммарном уравнении исключаем число одинаковых частиц, находящихся как в левой, так и в правой частях равенства (приводим подобные). В данном случае это ионы Н+ и Н2О.
Краткое ионно-молекулярное уравнение будет иметь вид
2MnO 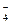 + 6H+ + 5NO
+ 6H+ + 5NO 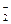 ® 2Mn2+ + 3H2O + 5NO
® 2Mn2+ + 3H2O + 5NO 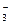 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 5 NaNO2 + 3 H2SO4 = 2MnSO4+5NaNO3 + 3H2O + K2SO4.
Проверка:
- Баланс по частицам, которые не участвовали в ОВР: K+ (2 = 2), Na+ (5 = 5), SO 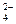 (3 = 3).
(3 = 3).
- Баланс по кислороду: 30 = 30.
2. Нейтральная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2O ® MnO2 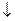 + NaNO3 + KOH
+ NaNO3 + KOH
Ионно-молекулярная схема реакции:
K+ + MnO 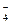 + Na+ + NO
+ Na+ + NO 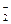 + H2O ® MnO2
+ H2O ® MnO2 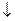 + Na+ + NO
+ Na+ + NO 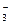 + K+ + OH
+ K+ + OH 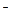
Краткая ионно-молекулярная схема:
+7 +3 +4 +5
MnO 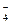 + NO
+ NO 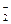 + H2O ® MnO2
+ H2O ® MnO2 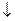 + NO
+ NO 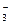 + OH-
+ OH-
ок-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:


 2 НОК MnO
2 НОК MnO 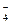 + 2H2O + 3eˉ ® MnO2
+ 2H2O + 3eˉ ® MnO2 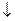 +4OH
+4OH 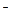 - процесс восстановления
- процесс восстановления
 6 -1 +(-3) = -4
6 -1 +(-3) = -4
3 NO 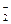 + H2O – 2eˉ ® NO
+ H2O – 2eˉ ® NO 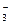 + 2H+ - процесс окисления
+ 2H+ - процесс окисления


 -1 - (-2) = +1
-1 - (-2) = +1
2MnO 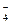 + 4H2O + 3NO
+ 4H2O + 3NO 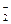 + 3 H2O ® 2MnO2
+ 3 H2O ® 2MnO2 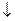
 + 8 OH- + 3NO
+ 8 OH- + 3NO 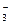 + 6H+.
+ 6H+.
Приводим подобные, учитывая:
8 ОН 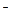
 + 6Н+ = 6Н2О + 2ОН
+ 6Н+ = 6Н2О + 2ОН 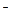 .
.
Краткое ионно-молекулярное уравнение:
2MnO 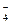 + 3NO
+ 3NO 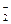 + H2O ® 2MnO2
+ H2O ® 2MnO2 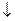 + 3 NO
+ 3 NO 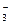 + 2OH
+ 2OH 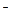 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 3NaNO2 + H2O ® 2MnO2 + 3NaNO3 + 2KOH.
Проверка:
- Баланс по кислороду: 15 = 15.
- Баланс по частицам, которые не участвовали в ОВР: Na+ (3 = 3); K+ (2 = 2).
3. Щелочная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + KOH ® K2MnO4 + NaNO3 + H2O.
Ионно-молекулярная схема реакции:
K++MnO 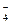 + Na++NO
+ Na++NO 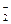 + K++ OH
+ K++ OH 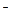 ® 2K++MnO
® 2K++MnO 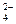 + Na++NO
+ Na++NO 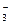 + H2O.
+ H2O.
Краткая ионно-молекулярная схема реакции:
+7 +3 +6 +5
MnO 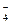 + NO
+ NO 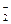 +OH
+OH 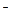 ® MnO
® MnO 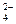 + NO
+ NO 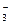 + H2O
+ H2O
oк-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:

 2 НОК MnO
2 НОК MnO 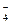 + 1e- ® MnO
+ 1e- ® MnO 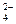 – процесс восстановления
– процесс восстановления

 1 NO
1 NO 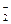 + 2OH
+ 2OH 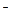 - 2e- ®NO
- 2e- ®NO 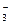 + H2O – процесс окисления
+ H2O – процесс окисления
 -3 - (-2) = -1
-3 - (-2) = -1
2 MnO 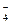 + NO
+ NO 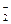 +2OH
+2OH 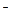 ® 2MnO
® 2MnO 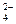 + NO
+ NO 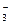 + H2O (краткое ионно-молекулярное уравнение).
+ H2O (краткое ионно-молекулярное уравнение).
В молекулярной форме уравнение имеет вид
2KMnO4 + NaNO2 + 2KOH ® 2K2MnO4 + NaNO3 + H2O
Проверка:
- Баланс по кислороду: 12 = 12.
- Баланс по частицам, которые не участвовали в ОВР: К+ (4 = 4); Na+ (1 = 1).
Дата добавления: 2015-08-11; просмотров: 4863;
