Распределения Максвелла и Больцмана. Явления переноса
План лекции:
1. Закон Максвелла о распределении молекул по скоростям. Характерные скорости молекул.
2. Распределение Больцмана.
3. Средняя длина свободного пробега молекул.
4. Явления переноса:
а).диффузия;
б).внутреннее трение (вязкость);
в).теплопроводность.
1. Закон Максвелла о распределении молекул по скоростям. Характерные скорости молекул.
Молекулы газа движутся хаотически и в результате столкновений скорости их меняются по величине и направлению; в газе имеются молекулы как с очень большими, так и с очень малыми скоростями. Можно поставить вопрос о числе молекул, скорости которых лежат в интервале от и для газа в состоянии термодинамического равновесия в отсутствии внешних силовых полей. В этом случае устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям , которое подчиняется статистическому закону , теоретически выведенному Максвеллом.
Чем больше общее число молекул N, тем большее число молекул DN будет обладать скоростями в интервале оти ;чем больше интервал скоростей 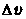 , тем у большего числа молекул
, тем у большего числа молекул 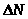 значение скоростей будет лежать в указанном интервале.
значение скоростей будет лежать в указанном интервале.
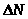 ~
~ 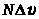
Введем коэффициент пропорциональности f(u).
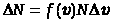 , (1)
, (1)
где f(u) называется функцией распределения, которая зависит от скорости молекул и характеризует распределение молекул по скоростям.
Если вид функции 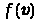 известен, можно найти число молекул
известен, можно найти число молекул 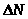 , скорости которых лежат в интервале от до .
, скорости которых лежат в интервале от до .
С помощью методов теории вероятности и законов статистики Максвелл в 1860г. теоретически получил формулу, определяющую число молекул 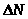 , обладающих скоростями в интервале от до .
, обладающих скоростями в интервале от до .
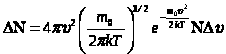 , (2)
, (2)
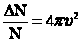
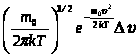 - распределение Максвелла показывает, какая доля
- распределение Максвелла показывает, какая доля 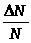 общего числа молекул данного газа обладает скоростями в интервале от до .
общего числа молекул данного газа обладает скоростями в интервале от до .
Из уравнений (1) и (2) следует вид функции 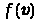 :
:
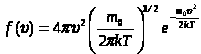 - (3)
- (3)
функция распределения молекул идеального газа по скоростям.
Из (3) видно, что конкретный вид функции 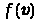 зависит от рода газа (от массы молекулы m0) и температуры.
зависит от рода газа (от массы молекулы m0) и температуры.
Наиболее часто закон распределения молекул по 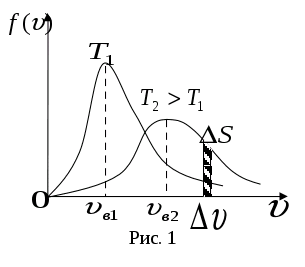 скоростям записывают в виде:
скоростям записывают в виде:
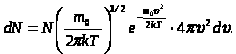
График функции 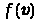 асимметричен (рис. 1). Положение максимума характеризует наиболее часто встречающуюся скорость, которая называется наиболее вероятной. Скорости, превышающие uв, встречаются чаще, чем меньшие скорости.
асимметричен (рис. 1). Положение максимума характеризует наиболее часто встречающуюся скорость, которая называется наиболее вероятной. Скорости, превышающие uв, встречаются чаще, чем меньшие скорости.
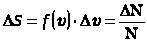 - доля общего числа молекул, обладающих скоростями в этом интервале.
- доля общего числа молекул, обладающих скоростями в этом интервале.
Sобщ.= 1.
С повышением температуры максимум распределения сдвигается в сторону больших скоростей, а кривая становится более пологой, однако площадь под кривой не изменяется, т.к. Sобщ.= 1.
Наиболее вероятной называют скорость, близкой к которой оказываются скорости большинства молекул данного газа.
Для её определения исследуем 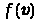 на максимум.
на максимум.
, 4 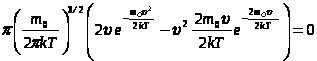 ,
,
, .
, 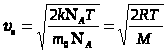 .
.
Ранее было показано, что
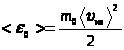 ,
, 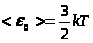 ,
,
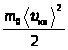 =>
=> 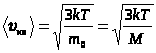 .
.
В МКТ используют также понятие средней арифметической скорости поступательного движения молекул идеального газа.
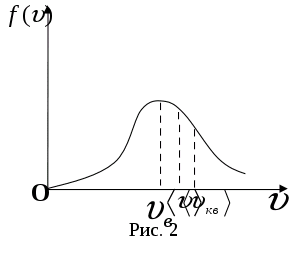
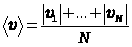 - равна отношению суммы модулей скоростей всех молекул к
- равна отношению суммы модулей скоростей всех молекул к
числу молекул.
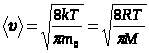 .
.
Из сравнения видно (рис.2), что наименьшей является uв.
2. Распределение Больцмана.
Два фактора - тепловое движение молекул и наличие поле тяготения Земли приводят газ в состояние, при котором его концентрация и давление убывают с высотой.
Если бы не было теплового движения молекул атмосферного воздуха, то все они сосредоточились бы у поверхности Земли. Если бы не было тяготения, то частицы атмосферы рассеялись бы по всей Вселенной. Найдем закон изменения давления с высотой.
Давление столба газа определяется формулой .
Поскольку с увеличением высоты давление уменьшается,
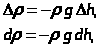
где r плотность газа на высоте h.
Найдем p из уравнения Менделеева- Клапейрона
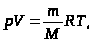
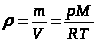
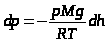 или .
или .
Проведем расчет для изотермической атмосферы, считая, что Т=const (не зависит от высоты).
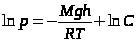 .
.
при h=0 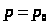 ,
, 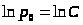 ,
, 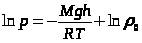 ,
,
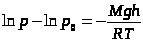 ,
, 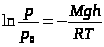 ,
, 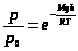 ,
,
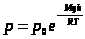 - барометрическая формула, определяет давление газа на любой высоте.
- барометрическая формула, определяет давление газа на любой высоте.
Получим выражение для концентрации молекул на любой высоте.
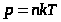
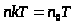
 ,
, 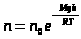
Т. к. 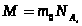 , а
, а 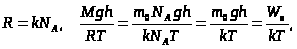
где 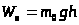 - потенциальная энергия молекулы на высоте h.
- потенциальная энергия молекулы на высоте h.
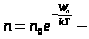 распределение Больцмана во внешнем потенциальном поле.
распределение Больцмана во внешнем потенциальном поле.
Следовательно, распределение молекул по высоте есть их распределение по энергиям. Больцман доказал, что это распределение справедливо не только в случае потенциального поля сил земного тяготения, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
Из распределения Больцмана следует, что молекулы располагаются с большей концентрацией там, где их потенциальная энергия меньше.
Распределение Больцмана - распределение частиц в потенциальном силовом поле.
3. Средняя длина свободного пробега молекул.
Вследствие хаотического теплового движения молекулы газа непрерывно сталкиваются друг с другом, проходят сложный зигзагообразный путь. Между 2-мя столкновениями молекулы движутся равномерно прямолинейно.
М 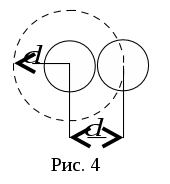 инимальное расстояние, на которое сближаются центры 2-х молекул при соударении, называется эффективным диаметром молекулы d (рис. 4).
инимальное расстояние, на которое сближаются центры 2-х молекул при соударении, называется эффективным диаметром молекулы d (рис. 4).
Величина 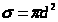 называется эффективным сечением молекулы.
называется эффективным сечением молекулы.
Найдем среднее число столкновений молекулы однородного газа в единицу времени. Столкновение произойдёт, если центры молекул сблизятся на расстояние, меньшее или равное d. Предполагаем, что молекула движется со скоростью 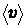 , а остальные молекулы покоятся. Тогда число столкновений определяется числом молекул, центры которых находятся в объёме, представляющем собой цилиндр с основанием
, а остальные молекулы покоятся. Тогда число столкновений определяется числом молекул, центры которых находятся в объёме, представляющем собой цилиндр с основанием 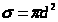 и высотой, равной пути, пройденном молекулой за 1с, т.е.
и высотой, равной пути, пройденном молекулой за 1с, т.е. 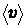 .
.
В  действительности все молекулы движутся, и возможность столкновения 2-х молекул определяет их относительная скорость. Можно показать, что если для скоростей молекул принято распределение Максвелла,
действительности все молекулы движутся, и возможность столкновения 2-х молекул определяет их относительная скорость. Можно показать, что если для скоростей молекул принято распределение Максвелла, 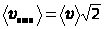 .
.
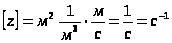 .
.
Для большинства газов при нормальных условиях
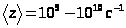 .
.
Средняя длина свободного пробега - это среднее расстояние, которое проходит молекула между двумя последовательными соударениями. Оно равно отношению пройденного за время Dt пути к числу соударений за это время:
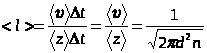
Для большинства газов при нормальных условиях 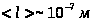 .
.
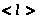 обратно пропорциональна концентрации молекул.
обратно пропорциональна концентрации молекул.
Поскольку 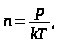
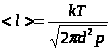
При T =const 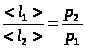 ,
, 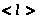 обратно пропорциональна давлению.
обратно пропорциональна давлению.
Дата добавления: 2015-08-11; просмотров: 2270;
