Уравнение состояния идеального газа и основное уравнение МКТ
1. Основные положения и основные понятия МКТ.
2. Уравнение состояния идеального газа. Опытные газовые законы.
3. Основное уравнение МКТ идеальных газов.
Основные положения и основные понятия МКТ.
Существуют два основных метода описания физических явлений и построения соответствующих теорий:
1) молекулярно-кинетический (статистический);
2) термодинамический.
Молекулярно-кинетический метод рассматривает свойства физических объектов как суммарный результат действия всех молекул.
Поведение отдельной молекулы анализируется на основе законов классической механики, и полученные результаты распространяются на совокупность большого числа молекул с помощью статистического метода, использующего законы теории вероятности. Это возможно, поскольку движение каждой молекулы хотя и проходит по законам классической механики, но является случайным, т.к. скорости молекул подчиняются законам теории вероятности. Чем больше частиц в системе, тем лучше совпадают выводы статистической теории с результатами эксперимента.
Преимущество метода - ясная картина механизма рассматриваемого явления.
Недостаток - выводы МК теории являются результатом усреднения, поэтому являются приближенными.
Термодинамический метод основывается на введении понятия энергии и рассматривает все процессы с энергетической точки зрения, основываясь на законах сохранения и превращения энергии из одного вида в другой.
Молекулярная физика - раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетической теории.
|
Основные положения МКТ базируются на ряде опытных данных и наблюдений (диффузия, броуновское движение).
1. Все вещества состоят из атомов или молекул.
2. Атомы всех веществ находятся в беспрестанном хаотическом движении.
3. Атомы (или молекулы) всех веществ взаимодействуют между собой.
Диффузия - явление проникновения молекул одного вещества между молекулами другого при их соприкосновении.
Броуновское движение – хаотическое движение взвешенных в жидкости или газе частиц.
Молекула - мельчайшая частица вещества, обладающая всеми его химическими свойствами.
mм» 10-26 кг, d» 10-10м.
Молекулярная масса - масса одной молекулы, измеряется в а.е.м.
| вещество | масса м-лы (а.е.м.) | масса вещества (г) | число молекул |
| Н2 | 6,02×1023 | ||
| С | 6,02×1023 | ||
| О2 | 6,02×1023 | ||
| СО2 | 6,02×1023 |
1 моль - это количество вещества, в котором содержится столько атомов (или молекул), сколько их содержится в 12 г основная единица СИ.
Число Авогадро NА - это число атомов (или молекул), содержащихся в одном моле любого вещества. Молярная масса - масса одного моля.
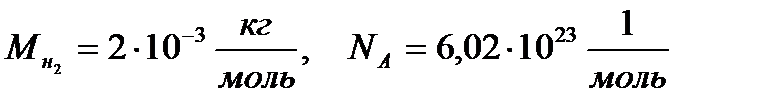
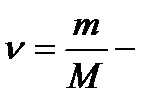 число молей вещества
число молей вещества
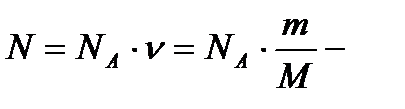 число атомов (молекул) вещества
число атомов (молекул) вещества
Дата добавления: 2015-08-11; просмотров: 1316;
