Реальные газы
Уравнение состояния реального газа получено в 1873 году голландским физиком Я. Д. Ван-дер-Ваальсом, который ввел в уравнение Менделеева-Клапейрона поправку на размер молекул и учел силы взаимодействия между ними. Это уравнение носит его имя и имеет вид:
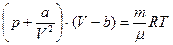 (3.27)
(3.27)
где а и b поправки на силы взаимодействия молекул и собственной объем. Уравнение Ван-дер-Ваальса хорошо описывает качественную картину явления, но не дает достаточной количественной точности. Однако изучение изотермических процессов привело к весьма интересным в практическом отношении выводам. Прежде всего было введено понятие критической температуры, при которой исчезают

силы сцепления между молекулами жидкости и жидкость превращается в пар независимо от давления и занимаемого объема. Критической называется такая температура, при которой плотность жидкости и ее насыпанного пара становится одинаковой. При температурах же выше критической вещество может существовать только в газообразном состоянии. Газ, температура которого выше критической, не может быть никаким сжатием переведен в жидкое состояние. Следовательно, газ, находящийся при температуре, большей критической, отличается от газа, находящегося при температуре меньшей критической. В этой связи газ, находящийся при температуре, меньшей критической, называется паром. Критические температуры для ряда веществ имеют значения в К: вода - 647, кислород - 154, воздух - 132, водород - 33. Отсюда следует, что вода в нормальных атмосферных условиях находится при температуре, меньшей критической, и поэтому может существовать как в жидком, так и газообразном (парообразном) состояниях. Воздух и водород в нормальных атмосферных условиях могут существовать только в газообразном состоянии.
Внутренняя энергия реального газа является функцией двух параметров: температуры Т и объема V. Для киломоля она определится формулой:
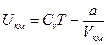 (3.28)
(3.28)
Из выражения (3.28) следует, что внутренняя энергия увеличивается при повышении температуры Т и увеличении объема V.
Если газ будет расширяться или сжиматься без теплообмена с внешней средой и без совершения внешней работы, то согласно первому началу термодинамики его внутренняя энергия должна оставаться постоянной. В этом случае дифференцирование выражения (3.28) даст:


откуда следует, что dT и dV  имеют разные знаки. Следовательно, при расширении в таких условиях газ должен всегда охлаждаться, а при сжатии - нагреваться. Понятие критической температуры сыграло большую роль в физике низких температур и технике сжижения газов. Благодаря этому стало очевидным, что любой газ
имеют разные знаки. Следовательно, при расширении в таких условиях газ должен всегда охлаждаться, а при сжатии - нагреваться. Понятие критической температуры сыграло большую роль в физике низких температур и технике сжижения газов. Благодаря этому стало очевидным, что любой газ

можно превратить в жидкость путем сжатия с предварительным охлаждением до температуры, меньшей критической. В технике для сжижения газов широко применяются машина Линде и детандеры.
Жидкие газы с низкой температурой кипения хранятся в сосудах Дыоара. Получение жидких газов имеет большое практическое значение хотя бы потому, что физические свойства многих веществ при температуре сжиженных газов подвержены изменениям. Например, многие металлы становятся сверхпроводниками, а гелий при температуре меньше 2,2К становится сверхтекучим. Во многих случаях сами жидкие газы находят применение в практике. Например, жидкий воздух имеет при атмосферном давлении температуру -180°С. При его испарении в первую очередь улетучивается азот и остается жидкий кислород. Таким путем можно отделить друг от друга основные составляющие атмосферного воздуха и использовать их для различных целей. Из чистых азота и водорода при повышенных давлениях на специальных катализаторах получают аммиак. Жидкий кислород применяется в медицине, автогенной сварке, для ускорения доменного процесса. Смешанный с органическими горючими он дает взрывчатые вещества, так называемые оксиликвиты, применяемые в горнорудной промышленности и дорожном строительстве.
Свойства реальных газов широко используются для совершенствования техники и технологии производств.
Дата добавления: 2015-08-11; просмотров: 893;
